
| 选项 | 离子组 | 分析 |
| A | Na+、Cu2+、SO42-、Cl- | 能大量共存于同一溶液中,通入过量NH3最终产生蓝色沉淀 |
| B | NH4+、Al3+、S2-、Cl- | 不能大量共存于同一溶液中,因为有Al2S3沉淀产生 |
| C | H+、Fe2+、SO42-、Cl- | 能大量共存于同一溶液中,加入KNO3固体后溶液颜色发生变化 |
| D | Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为HCO3-与OH-反应有CO2生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该组离子之间不反应,通入过量NH3生成四氨合铜络离子;
B.Al3+、S2-相互促进水解生成氢氧化铝沉淀和硫化氢气体;
C.该组离子之间不反应,加入KNO3固体,Fe2+、NO3-、H+发生氧化还原反应;
D.HCO3-、OH-结合生成碳酸根离子和水.
解答 解:A.该组离子之间不反应,通入过量NH3生成四氨合铜络离子,不能得到蓝色沉淀,故A错误;
B.Al3+、S2-相互促进水解生成氢氧化铝沉淀和硫化氢气体,不能得到Al2S3沉淀,故B错误;
C.该组离子之间不反应,加入KNO3固体,Fe2+、NO3-、H+发生氧化还原反应生成铁离子,溶液颜色发生变化,故C正确;
D.HCO3-、OH-结合生成碳酸根离子和水,不能生成二氧化碳气体,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、水解反应的离子共存考查,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:填空题
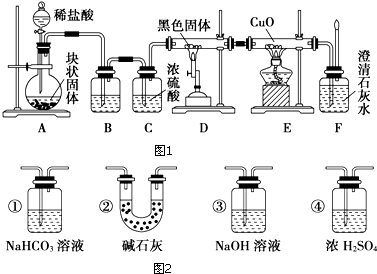
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
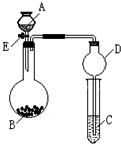 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
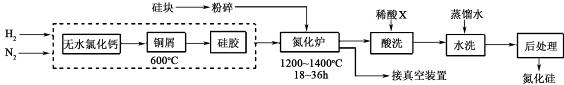
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
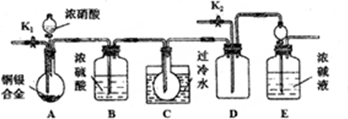
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com