
A��B��C��D��E��F��G��ԭ��������������Ķ�����Ԫ�أ�����A��E��D��Gͬ���壬��D��G����������֮����A��E����������֮�͵�2����A��B��C��D�ɷֱ��γ�10���ӷ��ӣ�E��F��GԪ������������Ӧˮ����֮����������Ӧ����ش���������
��1��E��G����Ԫ�صķ��ţ�E ��G ��F��Ԫ�����ڱ��е�λ���� .
(2)Zn��ϡ���ᷴӦ�������������ͭ��Һ��Ӧ���ʻ���ӿ죬��ԭ���� ��
(3) E��D2��ȼ�����ɻ�����X���������Ӹ�����Ϊ ��X�е������ӵ���ʽΪ .
 (4)�ܹ�˵�����淴Ӧ2CD2��g�� �� C2D4��g���ﵽƽ��״̬�ı�־�� ��
(4)�ܹ�˵�����淴Ӧ2CD2��g�� �� C2D4��g���ﵽƽ��״̬�ı�־�� ��
�ٵ�λʱ������2mol CD2��ͬʱ������1 mol C2D4
�ں��º�ѹ�£����������ܶȲ���
��CD2��C2D4��Ũ��֮��Ϊ2��1
�ܻ���������ɫ����
�ݵ�λʱ������4mol CD2��ͬʱ������2mol C2D4
(5)��E������������ˮ����0.5 mol��ˮ��Һ��ͨ������BD2����11.2L���仯ѧ��Ӧ����ʽΪ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ����٤����������ֵ������˵����ȷ����(����)
A�������£�23g NO2����NA����ԭ��
B��1L 0.1mol��L��1�İ�ˮ����0.1NA��OH��
C�����³�ѹ�£�22.4LCCl4���и�NA��CCl4����
D��1molFe2+ ��������H2O2��Һ��Ӧ��ת��2NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ������ȷ����( )
A������������������Fe(OH)3��3H+��Fe3+��3H2O
B��С�մ���Һ�ʼ��Ե�ԭ��HCO3����H2O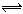 H3O����CO32��
H3O����CO32��
C���廯������Һ��ͨ������������2Fe2��+ 4Br��+ 3Cl2 = 2Fe3��+2 Br2 + 6Cl��
D�����������[NH4Al(SO4)2]��Һ�еμ�����Ba(OH)2��Һ��
NH4+��Al3+��2SO42����2Ba2+��5OH����AlO2����2BaSO4����NH3��H2O��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ��������ʵ����ʵ��������ȷ���ǣ�������
A�����������ʴ�ˮ���������ֲ��ı��������ʣ�Ӧ����CuSO4��Һ
B���Ҵ����Ա�����Ϊ���ᣬ���߶��ܷ� ��������Ӧ
��������Ӧ
C��������Һ�м���һ����ϡ���ᣬ����һ��ʱ�������Һ�м�������������ͭ����Һ��������У�δ����ɫ���������֤������û�з���ˮ��
D������NaOH��Һ��ȥ�������������е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��I��С���������о��¶ȶԷ�Ӧ���ʵ�Ӱ�족ʵ��ʱ����ȡ����ֻ�Թܣ�������4mL 0.01mol/L��KMnO4������Һ��2mL 0.1mol/L H2C2O4���Ҷ��ᣩ��Һ����A�Թ�������ˮ�У�B�Թ�������ˮ�У���¼��Һ��ɫ�����ʱ�䣮
����Ҫ���� ���ữKMnO4��Һ����ɫ����ʱ��tA ��tB�����������=����������
��д���÷�Ӧ�����ӷ���ʽ�� ����
��2��ʵ������ƿ������ɳ���Ҷ�����Ʒ��С�����������Ӧ��ԭ�����ⶨ�京����������� Ϊ��
������250mL��Һ��ȷ����5.0g�Ҷ�����Ʒ�����250mL��Һ��
�ڵζ���ȷ��ȡ25.00mL������Һ����ƿ�У����������ữ����0.1000mol��L��1KMnO4��Һװ���� �������ʽ����ʽ�����ζ��ܣ����еζ�������
��ʵ���з��֣��յ�������KMnO4��Һʱ����ҺѸ�ٱ���Ϻ�ɫ������ƿҡ��һ��ʱ����Ϻ�ɫ������ʧ���ټ����μ�ʱ���Ϻ�ɫ�ͺܿ���ɫ�ˣ������ԭ���� �������� ����֤���ﵽ�ζ��յ㣮
�ۼ��㣺���ظ���������2�Σ���¼ʵ���������£�
| ��� | �ζ�ǰ������mL�� | �ζ��������mL�� |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
������KMnO4��Һ��ƽ�����Ϊ�� ��mL����֪H2C2O4����Է�������Ϊ90�������Ʒ�Ĵ���Ϊ�� ����
�������������в����ᵼ�²ⶨ���ƫ�ߵ����� ����
A��δ�ñ�Ũ�ȵ�����KMnO4��Һ��ϴ�ζ���
B���ζ�ǰ��ƿ������ˮ
C���ζ�ǰ�ζ��ܼ��첿�������ݣ��ζ���������ʧ
D����С�Ľ���������KMnO4��Һ������ƿ��
E���۲����ʱ���ζ�ǰ���ӣ��ζ����ӣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ԫ���ڿ�ѧ�о����������������ŷdz��㷺����;��
(1)�������Ľ�������������һ�ܷɻ��������˾Ϳ���̧�������Ԫ�����ڱ��еı�ʾ����ͼ��ʾ����д���¿ո�

��Li��Ԫ�����ڱ��е�λ�ã� ��
��6.941�����壺 __________________________��
(2)���������ü������ܵ�������ʱ���γɵ�����һ���ЧӦ�������Ƴɵġ�
�����蘆�ԭ�ӽṹʾ��ͼ��
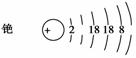
�������й�蘆�˵����ȷ����________��
A���䵥���ڳ�������ˮ��Ӧ�����ƾ���
B����ԭ�Ӱ뾶�ȼ�ԭ�Ӱ뾶С
C�������������ˮ��Һ����ʹ���������ܽ�
D����̼����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
W��X��Y��Z��Ϊ������Ԫ�أ�W������������������������֮��Ϊ7��17��X��Wͬ���壻Y��ԭ��������W��X��ԭ������֮�͵�һ�룻��ZԪ�ص�������ɫ��ӦΪ��ɫ�������ж���ȷ����(�� ��)
A�������ԣ�Y��Z B���⻯��ķе㣺X��W
C�����ӵĻ�ԭ�ԣ�X��W D�����Ӱ뾶��Z��Y��X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NA��ʾ�����ӵ�����������������ȷ����( )
A������ȼ�ϵ����������22.4L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
B��2 L0.5 mol • L��1�������Һ�����������������ΪNA
C��1 mol Na2O2�����к���������Ϊ4NA
D. 5NH4NO3 2HNO3+4N2����9H2O��Ӧ�У�����28 gN2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2����9H2O��Ӧ�У�����28 gN2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ά��֤ʵ�˹���շ����б仯��

��һ��ʵ�����ڽ������۵�ҹ�ӹ��ܺ�Ҷ�����ڹ�������о��м��ߵĹ��������ʵ�ԭ������˵���������(���� )
A��X��Y��Ϊͬ���칹�� B��X��Y�е�����ԭ�ӿ�����һ��ƽ����
C�������仯��һ���������� D��X��Y�����ܷ����Ӿ۷�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com