
| A. | 某种核素的相对原子质量 | |
| B. | 某种核素的质量数 | |
| C. | 某种元素所有核素质量数的平均值 | |
| D. | 某种元素的平均相对原子质量的近似值 |
科目:高中化学 来源: 题型:解答题
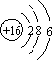 ;羰基硫分子的电子式为
;羰基硫分子的电子式为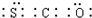 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
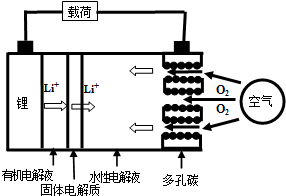
| A. | 放电时负极的电极反应式为:Li-e-=Li+ | |
| B. | 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到 | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: | B. | 氯离子的结构示意图: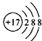 | ||
| C. | 溴原子的价层电子排布式:4s24p5 | D. | 过氧化钠的电子式: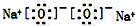 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3m+n)mol | B. | (3m+n+2p)mol | C. | (2.5m+0.5n-3p)mol | D. | (2.5m+0.5n)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA | |
| B. | 0.1molCmH2n+2中含有的碳碳单键数为0.1nNA | |
| C. | 2.8g乙烯和丙烯的混合气体中所含碳原子为0.2NA | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. |  +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com