
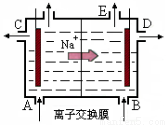
(12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H2,电解食盐水的离子方程式为: ,溶液变红色的是: 区(填A或B)。
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极 正极
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计
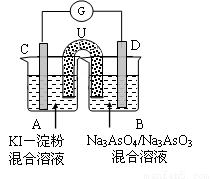
此装置中进行的反应是可逆反应,其反应方程式式为:AsO43-+2I-+H+ AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
⑴2Cl-+2H2O Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
⑵吸氧腐蚀的电极反应式:负极 Fe- 2e-=Fe2+ 正极 O2+4e-+2H2O=4OH-
⑶实验现象是 溶液由无色变蓝色 电极反应式为 AsO43-+2e-+2H+=AsO33-+H2O
【解析】
试题分析:(1)电解时在溶液中阳离子Na+、H+的放电能力H+ >Na+,所以在阴极发生反应:2H++2e-= H2↑,随着H+的不断放电,破坏了附近的水的电离平衡,最终使附近的水溶液显碱性,所以滴加酚酞溶液变为红色。即B区溶液变为红色;由于阴离子的沸点能力:Cl->OH-,在阳极Cl-放电产生氯气2Cl—2e-= Cl2↑,电解的总方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-。(2)钢铁发生吸氧腐蚀时Fe作负极,杂质C作正极。负极的电极反应式Fe- 2e-=Fe2+;正极的电极反应使是O2+4e-+2H2O=4OH-。(3)根据盐桥的示意图可知:在A杯中I-失去电子变为I2,I2遇淀粉变为蓝色。因此A烧杯的主要实验现象是溶液由无色变蓝色;在D电极上发生的电极反应为AsO43-+2e-+2H+=AsO33-+H2O。因此C为负极,D为正极。
Cl2↑+H2↑+2OH-。(2)钢铁发生吸氧腐蚀时Fe作负极,杂质C作正极。负极的电极反应式Fe- 2e-=Fe2+;正极的电极反应使是O2+4e-+2H2O=4OH-。(3)根据盐桥的示意图可知:在A杯中I-失去电子变为I2,I2遇淀粉变为蓝色。因此A烧杯的主要实验现象是溶液由无色变蓝色;在D电极上发生的电极反应为AsO43-+2e-+2H+=AsO33-+H2O。因此C为负极,D为正极。
考点:考查原电池、电解池的反应原理、电极反应、实验现象的等知识。


科目:高中化学 来源:2013-2014四川省成都市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数,下列说法一定正确的是
A、4g D2和足量O2反应可生成D2O 2NA个
B、1molNa完全燃烧可转移电子NA个
C、6.02×1023个葡萄糖分子约含羟基6NA个
D、98g H3PO4和H2SO4的混合物中含氢原子2.5NA个
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高二下学期期中联考化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关,下列叙述不正确的是( )
A. 食品保鲜膜按材质分为聚乙烯、聚氯乙烯,它们都属于链状高分子,受热易熔化
B. 食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
C. 人造纤维、合成纤维和光导纤维都是有机高分子化合物,符合Cn(H2O)m的组成
D. 控制含磷洗涤剂的使用,为了防止水体富营养化,保护水资源
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl。以下对铊的单质及其化合物的性质推断中,不正确的是( )
A、铊是易导电的银白色金属 B、铊能生成+3价的离子
C、Tl3+的氧化能力比Al3+强 D、氢氧化铊的碱性比氢氧化铝强
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
据报道,放射性同位素钬(16667Ho)可有效地治疗肝癌,该同位素原子的核内中子数与核外电子数之差是
A、166 B、67 C、99 D、32
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
有八种物质:①甲烷、②苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷、⑦邻二甲苯、
⑧环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是
A.③④⑤⑧ B.④⑤⑧ C.④⑤⑦⑧ D.③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
FePO4+Li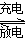 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。
下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性 B.放电时Li+向负极移动
C.充电过程中,电池正极材料的质量减少 D.放电时电池正极反应为:Li-e-=== Li+
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:推断题
(13分)硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
实验操作 | 实验现象 | 现象解释(用离子方程式表示) |
探究①A. B.向pH=2的硫酸中滴加Na2S2O3溶液 | a.溶液pH=8 b. | i. ii. S2O32-+2H |
探究②C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii. |
【实验结论】探究① 探究② 。
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质 。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由: 。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:填空题
(共4分)在一个固定体积为2升的密闭容器中,充入2molA和1molB, 发 生如下反应: 2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为: (填“吸热”或“放热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com