
| A. | H2O2+SO2═H2SO4 | B. | I2+2Fe2+═2I+2Fe3+ | ||
| C. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | D. | SO2+2H2O+I2═H2SO4+2HI |
分析 根据氧化还原反应中还原剂的还原性大于还原产物的还原性,利用酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-来判断反应能否发生.
解答 解:A、若该反应发生,S元素的化合价升高,O元素的化合价降低,则H2O2为氧化剂,还原性强弱为SO2>H2O2,与已知的还原性强弱相符合,故A能发生;
B、因该反应中Fe元素的化合价升高,碘元素的化合价降低,则Fe2+为还原剂,还原性强弱为Fe2+>I-,与已知的还原性强弱不一致,故B不能发生;
C、因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,故C能发生;
D、因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>I-,与已知的还原性强弱一致,故D可能发生;
故选B.
点评 本题考查还原性强弱的判断,学生应学会利用化合价来分析反应中的还原剂和还原产物,并利用还原剂的还原性大于还原产物的还原性来解答即可,题目难度不大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 加强废旧塑料的回收与利用,能有效地治理白色污染 | |
| B. | 合成塑料、合成纤维、合成橡胶是三大合成材料 | |
| C. | 线型结构的塑料具有热塑性 | |
| D. | 塑料、纤维素、蛋白质、天然橡胶属于天然高分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
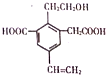
| A. | 1mol该物质,最多可以加成4molH2 | |
| B. | 该物质消耗Na、NaOH、NaHCO3的物质的量比为3:2:2 | |
| C. | 可以用酸性高锰酸钾溶液检验其中的碳碳双键 | |
| D. | 该物质能够在催化剂作用下被氧化为含醛基的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
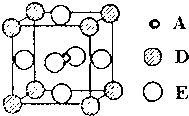 A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.
A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 1,3-丁二烯与足量氢气加成(丁烷) | |
| C. | 氯气与苯用氯化铁作催化剂反应(氯苯) | |
| D. | 等物质的量的氯气与乙烷在光照条件下反应(氯乙烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 油脂没有固定的熔沸点 | |
| C. | 葡萄糖、果糖、蔗糖都能发生水解反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+H→H-H | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O | |
| D. | H2SO4+2KOH═K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
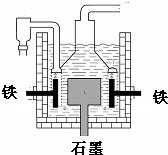 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:1 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com