
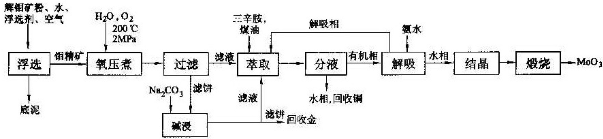
分析 辉钼矿进行浮选得到钼精矿,(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,CuFeS2被氧化为CuSO4、Fe2(SO4)3.过滤的滤饼用碳酸钠碱浸,再利用过滤的滤饼回收Au,说明浮选除去Fe2O3、Al2O3、SiO2.氧压煮过滤的滤液中含有H2MoO4、CuSO4、Fe2(SO4)3,将碱浸后的滤液合并,用三辛胺进行萃取,分液,水相中含有Fe3+、Cu2+,可以加入Fe回收Cu.有机相再用氨水解吸,有机相可循环,水相结晶、煅烧得到MoO3.
(1)向矿浆加入起泡剂充分搅拌,MoS2等附着在气泡上由刮泡器刮取,经烘干的钼精矿,不涉及溶解、化学变化,也不是利用密度分离,可能是利用物质的亲水性或亲油性;
(2)由上述分析可知,底泥的主要成分是Fe2O3、Al2O3、SiO2;
(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,需要有氧气、水参与,硫元素被氧化为硫酸;
(4)①H3Mo6Oy-21中Mo的化合价与H2MoO4中相同,为+6价,根据化合价电荷数计算y的值;
②[NH(C8H17)3]2Mo2O7难电离,可用氨水解吸,分液得到二钼酸钠(Na2Mo2O7)溶液和三辛胺的煤油溶液,三辛胺为N(C8H17)3,则还生成NH4+;
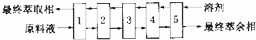
③Mo的提取为多段逆流萃取,这种萃取的优点是溶剂与原料液充分接触,有利于提高萃取率;
④最终萃取余相中含有Fe3+、Cu2+,可以用Fe进行还原;
(5)根据Mo元素守恒守恒计算.
解答 解:辉钼矿进行浮选得到钼精矿,(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,CuFeS2被氧化为CuSO4、Fe2(SO4)3.过滤的滤饼用碳酸钠碱浸,再利用过滤的滤饼回收Au,说明浮选除去Fe2O3、Al2O3、SiO2.氧压煮过滤的滤液中含有H2MoO4、CuSO4、Fe2(SO4)3,将碱浸后的滤液合并,用三辛胺进行萃取,分液,水相中含有Fe3+、Cu2+,可以加入Fe回收Cu.有机相再用氨水解吸,有机相可循环,水相结晶、煅烧得到MoO3.
(1)向矿浆加入起泡剂充分搅拌,MoS2等附着在气泡上由刮泡器刮取,经烘干的钼精矿,不涉及溶解、化学变化,也不是利用密度分离,可能是利用物质的亲水性或亲油性,
故答案为:B;
(2)由上述分析可知,底泥的主要成分是Fe2O3、Al2O3、SiO2,
故答案为:Fe2O3、Al2O3、SiO2;
(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,需要有氧气、水参与,硫元素被氧化为硫酸,反应方程式为:2MoS2+9O2+6H2O=2H2MoO4+4H2SO4,
故答案为:2MoS2+9O2+6H2O=2H2MoO4+4H2SO4;
(4)①H3Mo6Oy-21中Mo的化合价与H2MoO4中相同,为+6价,则1×3+6×6-2×21=-y,故y=3,
故答案为:3;
②[NH(C8H17)3]2Mo2O7难电离,可用氨水解吸,分液得到二钼酸钠(Na2Mo2O7)溶液和三辛胺的煤油溶液,三辛胺为N(C8H17)3,则还生成NH4+,离子方程式为:②[NH(C8H17)3]2Mo2O7+2NH3.H2O=2 N(C8H17)3+Mo2O72-+2NH4++2H2O,
故答案为:②[NH(C8H17)3]2Mo2O7+2NH3.H2O=2 N(C8H17)3+Mo2O72-+2NH4++2H2O;
③Mo的提取为多段逆流萃取,这种萃取的优点是溶剂与原料液充分接触,有利于提高萃取率,
故答案为:溶剂与原料液充分接触,有利于提高萃取率;
④最终萃取余相中含有Fe3+、Cu2+,氨水、氢氧化钠会沉淀铁离子、铁离子,可以用Fe进行还原,
故答案为:C;
(5)设理论上生产MoO3质量为xkg,根据Mo元素守恒守恒,则:
1.0×104kg×0.10%×$\frac{96}{96+64}$=x kg×$\frac{96}{96+48}$
解得x=9
故答案为:9.
点评 本题考查物质制备、化学与技术,涉及对工艺流程的理解、陌生方程式的书写、物质的分离提纯、化学计算等,基本抛弃中学内容,是对学生综合能力的考查,属于易错题目,难度较大.


科目:高中化学 来源: 题型:填空题
 ;
; +HBr→
+HBr→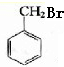 +H2O、
+H2O、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
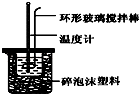 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
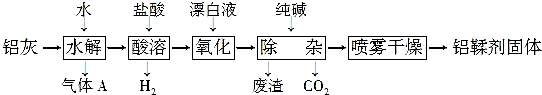
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

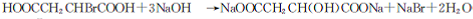 .
. +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向无水乙醇中加入浓H2SO4,加热至170℃,将产生的气体通入酸性KMnO4溶液中紫红色褪去,使溶液褪色的气体一定是乙烯 | |
| B. | 苯酚钠溶液中通入少量二氧化碳得到苯酚和碳酸钠溶液 | |
| C. | 正丁烷的所有碳原子都在同一条直线上 | |
| D. | 实验室可用电石与饱和食盐水反应制取乙炔气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com