
下列说法中正确的是
A.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为ΔH=-57.3kJ/mol
B.由C(石墨,s)= C(金刚石,s)ΔH=+1.9kJ/mol,可知金刚石比石墨稳定
C.在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确)
D.向存在着FeCl3 (黄色)+3KSCN 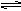 Fe(SCN) 3(血红色) +3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化
Fe(SCN) 3(血红色) +3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年重庆市高二上学期第三次月考化学试卷(解析版) 题型:填空题
(12分)I.下列说法不正确的是 (填字母代码)。
A.对于Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的
C.能源、信息与材料通常被称为现代社会发展的三大支柱
D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-) (填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+) 。
(3)若改加AgCl固体,则c(I-) ,而c(Ag+) 。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH 80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+) c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水 NaOH溶液中由水电离出的c(H+)水。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:填空题
(1)某温度下,纯水的[H+] =2.0×l0-7mol·L—l,则此时的[OH—]=__________。若温度不变,滴入稀硫酸使[H+] =5.0×l0-7mol·L—l.则[OH—]=_________,由水电离出的[H+]=__________。
(2)若l00℃时纯水电离出的[H+]为l.0×l0-6mol·L—l,此时Kw=__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:选择题
在一定温度下的某密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g) C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
A.混合气体的密度 B.混合气体的总物质的量
C.混合气体的压强 D.混合气体的总体积
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)I、水的电离平衡曲线如图1所示:
(1)若以A点表示在25℃时水电离平衡时的离子浓度,当温度升高到100℃时,水的电离平衡状态到达B点,则此时水的离子积从_________增加到__________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持25℃的恒温,致使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
II、物质A~D为CH3COOH、NaOH、HCl、NH3·H2O中的各一种,常温下将各物质的溶液从1 mL稀释到1000mL ,PH的变化关系如图2所示。请回答下列问题:
根据PH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式:
(3)将含等物质的量B和D的两溶液充分混合后,溶液呈现 性(填“酸”、“碱”或“中”),加热该溶液,则该溶液的PH (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高二上学期期末考试化学试卷(解析版) 题型:选择题
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:
A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不再变化时 ②容器内气体的压强不再变化时
③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时
⑤混合气体的平均相对分子质量不再改变的状态 ⑥当V正(B) = 2V逆(C)
A.①④⑤⑥ B.②③⑥ C.②④⑤⑥ D.只有④
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质中,不能按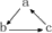 关系相互转化的是(“→”表示一步完成)
关系相互转化的是(“→”表示一步完成)
选项 | A | B | C | D |
a | SiO2 | NaOH | HNO3 | Cu |
b | Na 2SiO3 | Na2CO3 | NO | CuSO4 |
c | H2SiO3 | NaHCO3 | NO2 | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高一上学期期末考试化学试卷(解析版) 题型:选择题
如图两瓶体积相等的气体,在同温、同压时瓶内气体的关系一定正确的是

A.所含原子数相等 B.气体密度相等
C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:填空题
(12分)(1)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 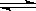 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)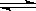 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: 。
(2)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式是 。
。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为 ,滴定终点时的颜色变化为 。
(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,会造成测定结果 。(填“偏大”、“偏小”或“无影响”)
(5)如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为 。
(6)怎样除去锅炉中难溶的硫酸钙沉淀?
(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2 。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,当混合溶液的pH=7时,H2SO4溶液与NaOH溶液的体积比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com