
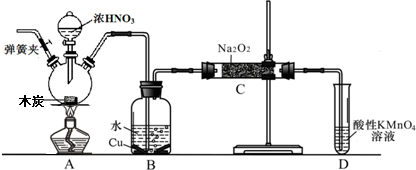
分析 (1)以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠,由于该实验中有气体参加,所以在组装好仪器后首先要检查装置的气密性,再装药品,由于实验过程中有一氧化氮产生,所以要将装置中的空气全部排尽,再进行实验,据此确定实验操作顺序;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(3)依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
(5)依据碳酸钠与强酸反应生成能使澄清石灰水变浑浊的气体证明产物中是否是碳酸钠;
(6)n(Na2O2)=$\frac{15.6g}{78g/mol}$=0.2mol,根据2NO+Na2O2=2NaNO2、3NO2+H2O=2HNO3+NO、C+4HNO3(浓) $\frac{\underline{\;△\;}}{\;}$CO2↑+4NO2↑+2H2O计算需要C的质量.
解答 解:(1)(1)以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠,由于该实验中有气体参加,所以在组装好仪器后首先要检查装置的气密性,再装药品,由于实验过程中有一氧化氮产生,所以要将装置中的空气全部排尽,再进行实验,所以实验操作顺序为⑤④③②①,
故答案为:⑤④③②①;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管口有无色气体冒出;除去未反应的NO,防止污染空气;
(3)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
故答案为:氢氧化钠; 碱石灰;
(5)检验碳酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生能使澄清石灰水变浑浊的气体,则产物有碳酸钠.
故答案为:取样,加入稀盐酸,若产生能使澄清石灰水变浑浊的气体,则产物有碳酸钠;
(6)n(Na2O2)=$\frac{15.6g}{78g/mol}$=0.2mol,根据2NO+Na2O2=2NaNO2知,0.2mol过氧化钠反应需要0.4molNO,根据3NO2+H2O=2HNO3+NO知生成0.4molNO需要1.2mol二氧化氮、根据C+4HNO3(浓) $\frac{\underline{\;△\;}}{\;}$CO2↑+4NO2↑+2H2O知生成1.2mol二氧化氮需要0.3molC,则C的质量=12g/mol×0.3mol=3.6g,
故答案为:3.6.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
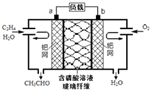 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | a电极发生还原反应 | |
| B. | 放电时,每转移2mol电子,理论上需要消耗28g乙烯 | |
| C. | b极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发→云→降水,这是地球水循环的过程,该过程主要是物理变化 | |
| B. | 海水中所含的常量元素大部分以盐的形式存在,其中含量最高的盐是氯化钠 | |
| C. | 海洋是化学元素的集散地,元素周期表所有的元素在海水中都能找到 | |
| D. | 由海水制备镁、氯、溴、碘等单质均需要涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a mol Na2O2中含有的离子数为4aNA | |
| B. | 100mL 1mol/L NaHCO3溶液中含有0.1NA个HCO3- | |
| C. | 标准状况下,2.24L氟化氢,其分子数为0.1NA | |
| D. | 28g N2和N4的混合气体中含有原子个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物对应水化物的酸性:Z>X | D. | Y、Z离子均能抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成22.4L氧气转移的电子数为2 NA | |
| B. | 18g D2O中含有的电子数和中子数均为10 NA | |
| C. | 密闭容器中2mol NO与1mol O2充分反应,产物的分子数为2 NA | |
| D. | 1mol Na与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去 NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com