
| A、进行中和滴定时,直接向刚洗净的锥形瓶中加待测液 |
| B、滴定未知浓度的盐酸所用的0.5mol?L-1 NaOH溶液时,用甲基橙为指示剂,在配制标准溶液时因与空气接触吸收了少量的CO2 |
| C、用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂 |
| D、往用蒸馏水洗净的滴定管中直接加入待测液,再注入锥形瓶中 |


科目:高中化学 来源: 题型:
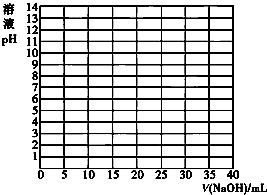 酸碱中和滴定常用于测定酸碱溶液的浓度.
酸碱中和滴定常用于测定酸碱溶液的浓度.| V/(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
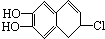 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )| A、1mol、2mol |
| B、2mol、3mol |
| C、3mol、2mol |
| D、3mol、3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )| A、2molBr2 2molNaOH |
| B、2molBr2 3molNaOH |
| C、3molBr2 4molNaOH |
| D、4molBr2 4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>③>② |
| B、③>②>① |
| C、②>③>① |
| D、①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
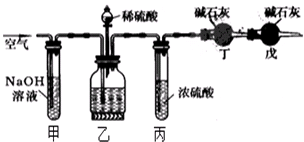 工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com