
| A. | 1 mol氢约含有阿伏伽德罗常数个氢 | |
| B. | 1 molCaCl2 含有1 molCl- | |
| C. | 1 mol电子约含有 6.02×1023个电子 | |
| D. | 1 mol H2O 含有 1 mol H2 和 1 mol O |
分析 A.使用物质的量应指明具体微粒种类;
B.1mol氯化钙含2mol氯离子;
C.依据N=nNA计算解答;
D.水分子是由氢原子与氧原子构成.
解答 解:A.氢可以为氢分子、氢原子,所以指代不明确,故A错误;
B.1 molCaCl2 含有2molCl-,故B错误;
C.1 mol电子约含有电子个数为:1mol×6.02×1023mol-1=6.02×1023个,故C正确;
D.1 mol H2O 含有 2 mol H2和 1 mol O,不含H2,故D错误;
故选:C.
点评 本题考查了物质的量、阿伏伽德罗常数应用,明确物质的量含义,熟悉物质的量使用方法和注意事项是解题关键,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮溶于水转化为无色气体且体积减小:3NO2+H2O═2HNO3+NO | |
| B. | 保存烧碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 不宜用无色试剂瓶保存氯水:2HClO$\frac{\underline{\;光照\;}}{\;}$ 2HCl+O2↑ | |
| D. | 铜与浓硫酸受热产生无色气体:Cu+2H+═Cu 2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧⑨⑩ | B. | ②③⑥⑦⑨ | C. | ②③⑥⑦ | D. | ④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
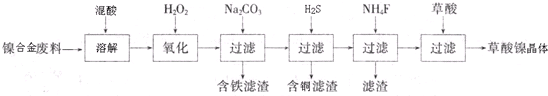
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③⑤⑦ | C. | ②⑤⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol | |
| B. | 1mol甲烷燃烧生成水蒸汽和二氧化碳所放出的热量是甲烷燃烧热 | |
| C. | 已知由石墨制备金刚石为吸热反应,则金刚石比石墨稳定 | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{q(am+bn)}{c(m+n-p)}$ | B. | $\frac{c(m+n-p)}{1000q(am+bn)}$ | ||
| C. | $\frac{c(m+n-p)}{q(am+bn)}$ | D. | $\frac{1000q(am+bn)}{c(m+n-p)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol的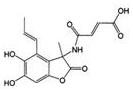 与NaOH溶液和H 2反应时,分别需要消耗NaOH 6.0mol和H 25.0mol 与NaOH溶液和H 2反应时,分别需要消耗NaOH 6.0mol和H 25.0mol | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na 2CO 3溶液鉴别 | |
| C. | 桶烯(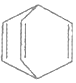 )与苯乙烯 )与苯乙烯 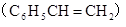 互为同分异构体,均属于芳香烃 互为同分异构体,均属于芳香烃 | |
| D. | 按系统命名法,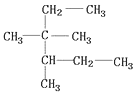 的名称为3,3二甲基2乙基戊烷 的名称为3,3二甲基2乙基戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com