
 ;
; +2H2O;
+2H2O;分析 (1)在Cu作催化剂、加热条件下,乙醇被催化氧化生成乙醛;
(2)在浓硫酸作催化剂、加热条件下,苯和浓硝酸发生取代反应生成硝基苯;
(3)乳酸中含有醇羟基和羧基,在浓硫酸作催化剂、加热条件下发生酯化反应生成环状化合物;
(4)该反应中Mn元素化合价由+7价变为+2价,则高锰酸根离子作氧化剂,二氧化硫作还原剂,S元素失电子化合价升高,由+4价变为+6价,因为在水溶液中进行的反应,所以生成SO42-,溶液呈酸性,所以生成氢离子,根据元素守恒知,反应物中还含有H2O,结合原子、电荷守恒配平方程式;
(5)根据方程式知,该反应中I元素化合价由-1价变为0价,则碘离子作还原剂,该反应中只有Cu元素能作氧化剂,因为A呈白色,所以不能是Cu单质,应该为Cu、I形成的化合物,0.2mol CuSO4与过量KI反应后可得38.2g 的A,A中n(I)=$\frac{38.2g-0.2mol×64g/mol}{127g/mol}$=0.2mol,则Cu、I的物质的量之比=0.2mol:0.2mol=1:1,从而确定其化学式.
解答 解:(1)在Cu作催化剂、加热条件下,乙醇被催化氧化生成乙醛,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(2)在浓硫酸作催化剂、加热条件下,苯和浓硝酸发生取代反应生成硝基苯,反应方程式为 ,
,
故答案为: ;
;
(3)乳酸中含有醇羟基和羧基,在浓硫酸作催化剂、加热条件下发生酯化反应生成环状化合物,反应方程式为2CH3CH(OH)COOH$→_{△}^{浓硫酸}$ +2H2O,故答案为:2CH3CH(OH)COOH$→_{△}^{浓硫酸}$
+2H2O,故答案为:2CH3CH(OH)COOH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;
(4)该反应中Mn元素化合价由+7价变为+2价,则高锰酸根离子作氧化剂,二氧化硫作还原剂,S元素失电子化合价升高,由+4价变为+6价,因为在水溶液中进行的反应,所以生成SO42-,溶液呈酸性,所以生成氢离子,根据元素守恒知,反应物中还含有H2O,结合原子、电荷守恒配平方程式为5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,
故答案为:2;5;2H2O;5SO42-;4H+;
(5)根据方程式知,该反应中I元素化合价由-1价变为0价,则碘离子作还原剂,该反应中只有Cu元素能作氧化剂,因为A呈白色,所以不能是Cu单质,应该为Cu、I形成的化合物,0.2mol CuSO4与过量KI反应后可得38.2g 的A,A中n(I)=$\frac{38.2g-0.2mol×64g/mol}{127g/mol}$=0.2mol,则Cu、I的物质的量之比=0.2mol:0.2mol=1:1,所以其化学式为CuI,故答案为:CuI.
点评 本题考查化学方程式书写、化学方程式配平、化学式确定等知识点,为高频考点,侧重考查基本理论,熟记常见有机反应类型、化学方程式配平方法,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散系的稳定性,将分散系分为溶液、胶体和浊液 | |
| B. | 根据是否具有丁达尔效应鉴别蛋白质溶液和氯化钠溶液 | |
| C. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,生成Fe(OH)3胶体 | |
| D. | “纳米材料”是粒子直径为1 nm~100 nm的材料,纳米铜是其中的一种,它是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将(CH3)3CCH2Cl与氢氧化钾的乙醇溶液加热一段时间后冷却,再滴加硝酸酸化的硝酸银溶液,可观察到有白色沉淀产生 | |
| B. | 新制氢氧化铜悬浊液可检验失去标签的乙醛、乙酸、乙酸乙酯、葡萄糖溶液(必要时可加热) | |
| C. | 制备乙酸乙酯时加入试剂的顺序是,在一支试管中加入3mL浓硫酸,然后慢慢加入2mL无水乙醇和2mL无水乙酸 | |
| D. | 向淀粉溶液中加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,若加热后未见砖红色沉淀生成 说明淀粉未开始水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: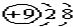 | |
| B. | 乙烷和丙烯互为同系物 | |
| C. | NaCl的电子式:Na${\;}_{×}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | H2、D2、T2属于同位素,化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锌为负极,Ag2O为正极? | B. | 放电时,正极附近pH值上升? | ||
| C. | 放电时,电子由Ag2O流向Zn | D. | 放电时,负极附近溶液pH值升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使品红褪色 | |
| B. | 能使湿润的蓝色石蕊试纸变红 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com