
分析 (1)AlCl3溶液在加热时水解生成Al(OH)3,Al(OH)3在加热条件下分解生成Al2O3;
(2)CuSO4是强酸弱碱盐,水解水溶液呈酸性;
(3)铝离子与碳酸氢根离子发生双水解生成氢氧化铝沉淀和二氧化碳气体;
(4)草木灰中含有碳酸钾,碳酸钾是强碱弱酸盐,水解呈碱性,铵根离子水解显酸性,混合后发生双水解反应,生成氨气从而导致土壤中铵根离子浓度较少,降低肥效;
(5)除去MgCl2酸性溶液中少量的FeCl3,利用加入的试剂调节溶液PH使铁离子完全沉淀,同时不能引入新的杂质;
(6)若在空气中加热MgCl2•6H2O,可生成Mg(OH)Cl,依据原子守恒书写化学方程式.
解答 解:(1)AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3.
故答案为:Al2O3;
(2)CuSO4是强酸弱碱盐,水解水溶液呈酸性,水解的离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+;
(3)泡沫灭火器原理,离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑;故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)草木灰中碳酸根离子水解呈碱性,铵态氮肥中铵根离子水解呈酸性,可发生互促水解,2NH4++CO32-+2H2O=2NH3•H2O+H2CO3,氨水和碳酸不稳定,容易分解为气体而降低肥效,NH3.H2O?NH3+H2O,H2CO3=CO2↑+H2O,所以二者不能混合施用,
故答案为:2NH4++CO32-+2H2O=2NH3•H2O+H2CO3,NH3.H2O?NH3+H2O,H2CO3=CO2↑+H2O;
(5)除去MgCl2酸性溶液中少量的FeCl3,利用加入的试剂调节溶液PH使铁离子完全沉淀,同时不能引入新的杂质;
a.MgO可以和酸反应调节溶液PH使铁离子沉淀,不引入新的杂质,故a符合;
b.Mg(OH)2 和酸反应调节溶液PH使铁离子沉淀,不引入新的杂质,故b符合;
c.MgCO3 和酸反应调节溶液PH使铁离子沉淀,不引入新的杂质,故c符合;
d.MgSO4和酸不反应,不能调节溶液PH使铁离子沉淀,引入新的杂质离子硫酸根离子,故d不符合;
故答案为:abc;
(6)若在空气中加热MgCl2•6H2O,可生成Mg(OH)Cl,依据原子守恒书写化学方程式为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑,
故答案为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑.
点评 本题考查了盐类水解的应用,除杂试剂选择原则,水解原理的分析应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是有机化合物 | B. | 都能发生酯化反应 | ||
| C. | 都是纯净物 | D. | 水溶液均呈酸性 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:填空题
将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g)  2HI(g) △H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g) △H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
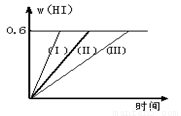
(1)达平衡时,I2(g)的物质的量浓度为mol/L 。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是 ,则乙条件可能是 。(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;④恒温条件下,扩大反应容器体积;⑤恒温恒容条件下,加入正催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入2mol I2(g)、4mol H2(g)发生反应,达平衡时,HI的体积分数是 0.6(填大于、等于、小于)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 5mol/L(NH4)2SO4溶液中含有NH4+数目为0.1NA | |
| B. | 100g质量分数为98%的浓硫酸中所含氧原子数为4NA | |
| C. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 | |
| D. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上第一次月考化学试卷(解析版) 题型:填空题
(1)9.03×1023个CH4中,含 mol碳原子, mol氢原子,
mol电子。标准状况下,CH4所占的体积为 L。
(2)与17 g NH3所含有分子数相同的氧气的体积(标准状况)是 L。
(3)某3.65 g气体在标准状况下的体积是2.24 L,则其摩尔质量是 。
(4)等质量的氧气和臭氧(O3),它们的物质的量之比为________,所含分子数之比为________,所含原子数之比为________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
分析下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)===2N2O(g) ΔH=163 kJ·mol-1
B.Ag(s)+ Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+ O2(g) ΔH=91 kJ·mol-1
O2(g) ΔH=91 kJ·mol-1
D.H2O2(l)=== O2(g)+H2O(l) ΔH=-98 kJ·mol-1
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com