
【题目】GaN、GaP、GaAs是人工合成的一系列新型半导体材料,其晶体结构均与金刚石相似。铜是重要的过渡元素,能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。回答下列问题:

(1)基态Ga原子价电子的轨道表达式为________________;
(2)熔点:GaN_____GaP(填“>”或“<”);
(3)第一电离能:As_____Se(填“>”或“<”);
(4)Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是______;
a.配位键 b.极性键 c.离子键 d.非极性键
(5)乙二胺分子中氮原子轨道的杂化类型为________,乙二胺和三甲胺[N(CH3)3]均属于胺。但乙二胺比三甲胺的沸点高很多,原因是___________;
(6)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,铜原子的半径为rcm。该晶体中铜原子的堆积方式为_______型(填“A1”、“A2”或“A3”),该晶体密度为____g/cm3(用含a和NA的代数式表达),该晶体中铜原子的空间利用率为______(用含a和r的代数式表达)。
【答案】 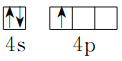 > > c sp3 乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键 A1
> > c sp3 乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键 A1 ![]()
![]()
【解析】(1)Ga原子是31号元素,根据构造原理写出Ga原子的电子排布式为1s22s22p63s23p63d104s24p1,价电子为4s24p1,基态Ga原子价电子的轨道表达式为![]() ;(2)GaN晶体结构与单晶硅相似,GaN属于原子晶体,N原子半径小于P,共价键键能大,熔点:GaN>GaP;(3)As的非金属性弱于Se,非金属性越强,第一电离能越大,但是由于As的p轨道电子处于半充满状态,故As的第一电离能>Se,第一电离能:As>Se;(4)铜离子提供空轨道,乙二胺中氮原子提供孤对电子形成配位键,乙二胺中两个碳形成非极性键,Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是离子键,故选C;(5)氮原子形成3个σ键和一对孤电子对,乙二胺分子中氮原子轨道的杂化类型为sp3;乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键,故乙二胺比三甲胺的沸点高很多;(6)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,铜原子的半径为rcm。该晶体中铜原子的堆积方式为A1;晶胞中Cu原子数为8×1/8+6×1/2=4,
;(2)GaN晶体结构与单晶硅相似,GaN属于原子晶体,N原子半径小于P,共价键键能大,熔点:GaN>GaP;(3)As的非金属性弱于Se,非金属性越强,第一电离能越大,但是由于As的p轨道电子处于半充满状态,故As的第一电离能>Se,第一电离能:As>Se;(4)铜离子提供空轨道,乙二胺中氮原子提供孤对电子形成配位键,乙二胺中两个碳形成非极性键,Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是离子键,故选C;(5)氮原子形成3个σ键和一对孤电子对,乙二胺分子中氮原子轨道的杂化类型为sp3;乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键,故乙二胺比三甲胺的沸点高很多;(6)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,铜原子的半径为rcm。该晶体中铜原子的堆积方式为A1;晶胞中Cu原子数为8×1/8+6×1/2=4,![]() ;晶胞中4个原子的体积为:
;晶胞中4个原子的体积为:![]() ,晶胞体积为a3,该晶体中铜原子的空间利用率为
,晶胞体积为a3,该晶体中铜原子的空间利用率为![]() 。
。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是
A. 烧菜用过的铁锅,经放置常出现红棕色斑迹
B. 用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量
C. 牛奶久置变质腐败
D. 氧化铜固体加入稀盐酸中,完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油化工产品1,3-丁二烯合成化工中间产品D (![]() )的合成路线如下:
)的合成路线如下:
已知:

(1)物质D中所含官能团名称为_________,一定条件下,1 molD最多与_________molH2发生加成反应。
(2)写出②⑥的反应类型分别是_________、_________。
(3)④反应的化学方程式_________。⑤反应的化学方程式_________。
(4)A 的系统命名是_________。
(5)写出与物质D互为同分异构体且满足以下条件的有机物结构简式_________。
① 能与FeCl3溶液发生显色反应
② 能发生银镜反应
③ 核磁共振氢谱显示有5组峰
(6)请设计合理方案用![]() 合成
合成![]() 。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁达尔效应是区分胶体与溶液的一种最常用的方法。
(1)下图是在实验室中进行Fe(OH)3胶体丁达尔效应实验的示意图,该图中有一处明显错误是______________________,原因是_______________________________ (试从分散系分类的角度进行解释说明)。

(2)欲在树林中观察到丁达尔效应,你认为一天中最有可能观察到该现象的时间是________,理由是_______________________________。
(3)去树林观察丁达尔效应有诸多不便,聪明的你想出了许多在家里看到丁达尔效应的方法,请设计一个你认为最简单、最环保的方法:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是

A.化合物XZW既含离子键也含共价键
B.对应气态氢化物的稳定性Y>Z
C.对应简单离子半径:X>W
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:

(1)组成青蒿素的三种元素电负性由大到小排序是 ,在基态O原子中,核外存在 对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是 (填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH + B(OCH3)3 → NaBH4+ 3CH3ONa
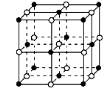
① NaH为 晶体,右图是NaH晶胞结构,则NaH晶体的配位数是 ,若晶胞棱长为a则Na原子间最小核间距为 。
② B(OCH3)3 中B采用的杂化类型是 。写出两个与B(OCH3)3 具有相同空间构型的分子或离子 。
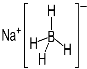
③ NaBH4结构如图所示。结构中存在的作用力有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铁和稀硫酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.氯化铝溶液中加入过量氨水制取氢氧化铝:Al3++3NH3·H2O![]() Al(OH)3↓+3
Al(OH)3↓+3![]()
C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu![]() Fe2++Cu2+
Fe2++Cu2+
D.氢氧化钠溶液中通入少量二氧化硫气体 :SO2+OH![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-) +c(HCO3-)
B. pH相同的盐酸和醋酸,分别用蒸馏水稀释至原体积的m倍和n倍稀释后两溶液pH 相等,则m>n
C. 常温下,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数为10-7
D. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图。由图可知:Ksp[Fe(OH)3]2]

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com