

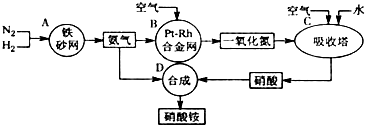
| A、若图I为合成氨,则其中N2、H2可循环使用 |
| B、若图I为合成SO3,则其中SO2、O2可循环使用 |
| C、若图Ⅱ为电解熔融MgCl2得到镁,则其中HCl可循环使用 |
| D、若图Ⅲ为氨氧化法制硝酸,则其中NO2可循环使用 |


科目:高中化学 来源: 题型:
| A、常温下在pH=1的溶液中:NH4+、K+、HCO3-、Cl- |
| B、有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- |
| C、有NO-3存在的强酸性溶液中:NH+4、Ba2+、Fe2+、Br- |
| D、常温下在pH=13的溶液中:Na+、S2-、PO43-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 石灰水 | 硫酸钡 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 冰醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
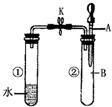 如图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾.则A与B可能是( )
如图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾.则A与B可能是( )| A、水与氮气 |
| B、稀硫酸与一氧化碳 |
| C、浓氢氧化钠溶液与二氧化碳 |
| D、饱和食盐水与氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
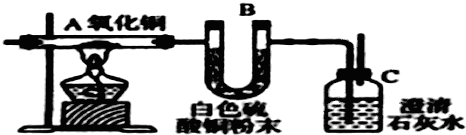
查看答案和解析>>
科目:高中化学 来源: 题型:
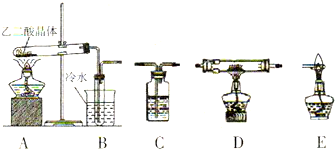
| 装置编号 | 装置中所加物质 | 装置作用 |
| B | -------- | |
| C | ||
| C | 氢氧化钠浓溶液 | |
| C | ||
| D | ||
| E | -------- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入试剂 | 0.1mol/LH2C2O4溶液 | 0.2mol/LH2C2O4溶液 |
| 实验现象 | ||
| 褪色时间 | 16s | 9s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2a=c-d-2b |
| B、a=c-d-2b |
| C、2a=c+d-2b |
| D、a=c+d-b/2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com