
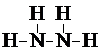 .
.
分析 甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中两种元素组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成份的相对分子质量相同,而空气的主要成分为氧气和氮气,如为氮气,则相对分子质量为28,没有符合物质,如为氧气,则相对分子质量为32,则该化合物含N的质量为32×87.5%=28,则甲含有N、H两种元素,分子式为N2H4,乙和丙是铜的两种常见氧化物,乙是新制的氢氧化铜与乙醛反应的还原产物,则乙为Cu2O,丙为CuO.
解答 解:甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中两种元素组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成份的相对分子质量相同,而空气的主要成分为氧气和氮气,如为氮气,则相对分子质量为28,没有符合物质,如为氧气,则相对分子质量为32,则该化合物含N的质量为32×87.5%=28,则甲含有N、H两种元素,分子式为N2H4,乙和丙是铜的两种常见氧化物,乙是新制的氢氧化铜与乙醛反应的还原产物,则乙为Cu2O,丙为CuO.
(1)甲为N2H4,结构式为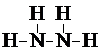
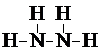
(2)甲和丙反应的产物中含有乙和一种气态单质,该气体单质为氮气,反应的方程式为:N2H4+4CuO=2Cu2O+N2↑+2H2O,故答案为:N2H4+4CuO=2Cu2O+N2↑+2H2O;
(3)向Cu2O固体中加入过量硫酸酸化的硫酸铁溶液,Cu2O固体完全溶解,得到透明溶液,应生成硫酸铜和硫酸亚铁,
①反应的离子方程式为:Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O,故答案为:Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O;
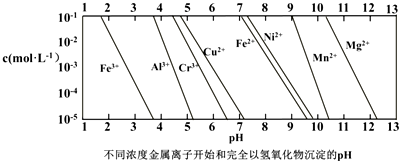
②反应后硫酸铁过量,由图象可知Fe3+完全沉淀时所需pH较小,则加入CuO消耗氢离子时,溶液pH不断增大,首先析出的沉淀是Fe(OH)3,故答案为:Fe(OH)3;
③由可逆反应2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)可知,可在有机相中加入盐酸或稀硫酸,则平衡向逆向移动,如溶液变成蓝色,可说明有机相中含有Cu2+,
故答案为:取有机层,加入盐酸或稀硫酸,振荡后水层呈蓝色,则证明有机相中含有铜元素.
点评 本题考查较为综合,涉及无机物的推断、物质的检验和鉴别等知识,侧重于学生的分析能力和实验能力的考查,注意把握题给信息,难度中等.


科目:高中化学 来源: 题型:解答题
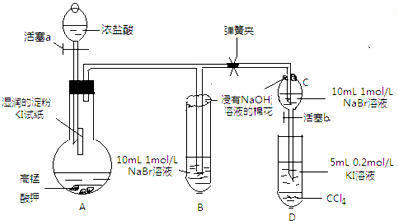 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| B. | 合成纤维是利用自然界的纤维材料通过化学合成方法得到的 | |
| C. | 研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果 | |
| D. | 碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、Cl-、S2-和SO42-可以大量共存 | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合,反应的离子方程式为:HSO3-+OH-=SO32-+H2O | |
| C. | NH4HSO3为弱酸弱碱盐,其水溶液pH>7 | |
| D. | c(NH4+)>c(HSO3-)>c(SO32-)>C(H2SO3)>C(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
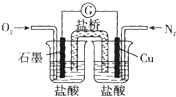
| A. | 石墨的电极反应:O2+2H20+4e-═4OH- | |
| B. | 此装置能将化学能转变为电能 | |
| C. | 电子由Cu电极经导线流向石墨电极 | |
| D. | 电池总反应:2Cu+O2+4HCl═2CuCl2+2H20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com