

A.2 B
(2)某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使紫色石蕊溶液变红,已知:

①化合物A和G的结构简式A:___________、G:___________。
②与G同类的同分异构体(含G)有___________种。
(3)某高聚物的结构如下:
![]()
合成该高聚物分子的结构简式为: ______________________、______________________。
解析:以上两题中都有判断有机物同分异构体数目的问题。确定同分异构体数目一般不必一一写出,关键在于有序思维。
第(1)小题硼氮苯分子与苯分子结构相同点是:都含正六边形的环;不同点是:苯环上的原子是6个C,硼氮苯环上的原子是B、N相间。解题时应将苯分子有两个取代基的位置关系迁移到本题上,然后找出不同点。根据所给硼氮苯分子结构式,两个氮原子在邻位时,总是硼、氮各一个氢被氯取代,只有一种取代物;两个氯原子在间位时则有两种情况——两个B上的H被取代或者两个N上的H被取代;两个氯在对位时则只有一种情况——B、N上各一个H被取代。C选项符合题意。
第(2)小题先求分子式,为C10H20,它的不饱和度为1(一个双键或者一个环),根据题中情景,A必然为含C=C双键的烯烃。根据题中给出的反应原理可知,一分子A生成了两分子G,G为羧酸(使石蕊试液变红),那么A分子应是对称的。确定A分子的结构式步骤为:
①C=C双键在中间且这两个C上各连一个H(氧化为—COOH)。
②两侧各有一个C上不连H,即含有![]() 结构。
结构。
由此可知A、G的结构简式分别为:
第(2)小题第②小问:与G同类的物质是羧酸,分子中含有一个—COOH,另一个则为—C4H9,—C4H9有四种结构,因此有四种同分异构体。
第(3)小题据高聚物的结构可推知合成其所用的分子为CH2=C(CH3) —CH=CH2、CH2=CH2。
答案:(1)C

②4
(3)CH2=C(CH3)—CH=CH2 CH2=CH2


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
 (2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出具有18个电子的A的氢化物的电子式_______________;写出一种具有三角锥形结构的BC3分子的化学式_______________。
(2)写出在BC3溶液中B3+离子与过量NaOH溶液反应的离子方程式_______________。
(3)写出D的单质与具有10个电子的A的氢化物在一定条件下反应的化学方程式_______________。
(4)向含有D的某种离子的溶液中加KSCN溶液后无明显现象,但再滴加A的某种氢化物后,溶液也变为红色,请写出此种D离子在酸性条件下与此种A的氢化物发生反应的离子方程式_____________________________________________。
(5)若向题中含有D的某种离子的溶液中,加入NaOH溶液,观察到的现象是。有关离子方程式或化学方程式是_______________、_______________。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期期中考试化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式 。
(2)用电子排布图表示F元素原子的价电子构型 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为 。
(4)离子半径D+ B3—,第一电离能B C,电负性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1∶1,X的电子式为 ,试写出Cu、稀H2SO4与X反应制备硫酸铜的离子方程式 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省宜春市高三4月模拟考试理综化学试卷(解析版) 题型:推断题
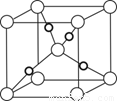
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E元素是第四周期元素中未成对电子数最多的元素,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl。F原子的一种核素的质量数为65,中子数为 36。请根据以上情况,回答下列问题:(答题时要用元素符号表示)
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是 .F元素原子的最外层电子数为 个。
(2)B3-离子分别与AC2、由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为 ;B3-离子还可以和一价阴离子互为等电子体,这阴离子电子式为 ,这种阴离子常用于检验日常生活中的一种金属阳离子,这金属阳离子符号为
(3)A、B、C的第一电离能由小到大的顺序为
(4)E3+的核外电子排布式是 ,ECl3形成的六配位的配合物化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(6)在F的+1价氧化物的晶胞结构如图,F为 球(“黑”“白”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com