
S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化合价升高,另一部分化合价降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
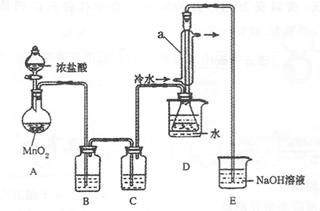
(1)检查装置的气密性(1分) (2)AD(2分)
(3)饱和食盐水(2分)浓硫酸 (2分) (4)冷凝回流、导气(2分)
(5)蒸馏(2分)
(6)2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑(写成3S2Cl2+4H2O= 5S↓+H2SO4+6HCl↑不扣分 ) (2分)
(7)ClO-+Cl-+2H+=Cl2↑+H2O(2分)
解析试题分析:(1)检查装置的气密性(2)制备Cl2要加热,加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,所以选AD(3)除去Cl2中的HCl和H2O,选择饱和食盐水,浓硫酸(4)认识冷凝管,了解其作用冷凝回流、导气(5)S2C12是一种金黄色易挥发的液体,沸点为138℃,采取蒸馏分离(6)缺少C装置,H2O进入装置D, S2Cl2在水中易发生歧化反应(7)多余的Cl2被NaOH吸收生成NaClO与HCl发生氧化还原反应。
考点:以实验为载体,考察了气体的制备、除杂和尾气处理,还有物质的分离,装置的作用


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:实验题
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)试剂X的化学式 。A中制取Cl2的离子方程式 。
(2)试剂Y的名称为 。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加BaCl2溶液 | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2?6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图: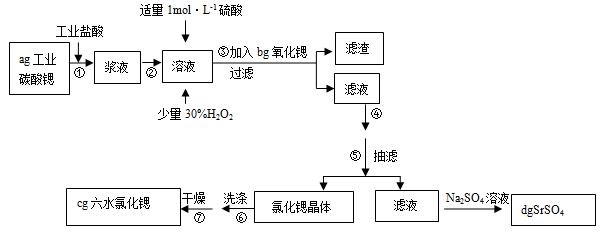
请回答:
(1)加入少量30%H2O2的作用 (用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ;
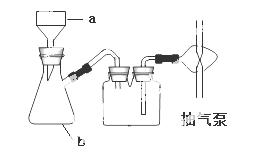
(3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
| A.水 | B.硫酸 | C.氢氧化钠溶液 | D.氯化锶饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下: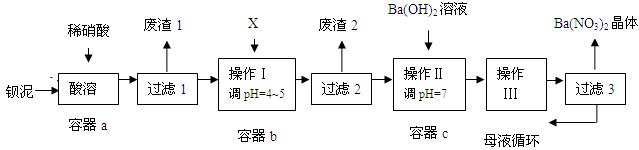
已知:① Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7
② Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小
③ KSP(BaSO4)=1.1×10-10,KSP (BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:
。
(3)该厂结合本厂实际,选用的X为 ;
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某工厂废液中含有苯酚、乙酸,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L—1NaOH、0.1 mol ?L—1KSCN、酸性KMnO4溶 液、FeCl3溶液、饱和溴水、紫色石蕊试液。
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤2:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于乙醇,熔点5.5℃,沸点267℃。1-萘酚(性质与苯酚相似)熔点96℃,沸点278℃,微溶于水,易溶于乙醇,乙醇的沸点为78.5℃。1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下: +C2H5OH
+C2H5OH
 +H2O
+H2O
1-萘酚 1-乙氧基萘
(1)将72g1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是 。烧瓶上连接长直玻璃管的主要作用是 。 
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是 (填序号)。
A.③②④① B.①②③④ C.②①③④
(3)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降的原因可能是 、 。
(4)某同学推测经提纯的产品可能还含有1-萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请在答题卡上完成表中内容。
| 实验目的 | 实验操作 | 预期现象和结论 |
| ①用金属钠检验1-乙氧基萘是否纯净 | 取少量经提纯的产品于试管A中,加入金属钠 | 若 ,则产品纯净; 若 ,则产品不纯。 |
| ②检验经提纯的产品是否含有1-萘酚 | | 若 ,则含有1-萘酚; 若 ,则不含1-萘酚。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验装置进行的相应实验,能达到实验目的的是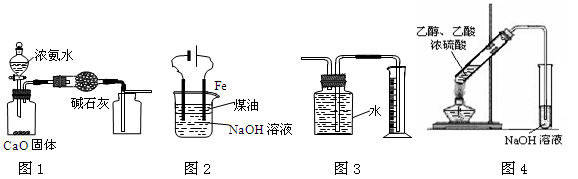
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.装置3收集并测量Cu与浓硝酸反应产生的气体及体积 |
| D.装置4可用于实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列①~④四个图是某学习小组设计的相关物质的制备装置,其中正确的是( )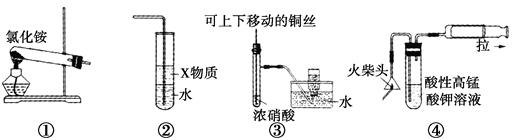
| A.用装置①可以制备氨气 |
| B.若装置②中X物质为苯,可用于实验室制备少量氨水,并防止发生倒吸 |
| C.装置③可用于制备并收集少量NO2气体 |
| D.装置④可用火柴头燃烧制备少量SO2,并检验产生的SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com