
| A. | 1:1 | B. | 3:5 | C. | 2:3 | D. | 3:2 |
分析 浓硫酸增重为燃烧生成水的质量,固体质量的过氧化钠发生反应:2CO2+2Na2O2 =2Na2CO3+O2,固体质量增重等于与二氧化碳等物质的量的CO的质量,令乙烷、丙烷的物质的量分别为xmol、ymol,根据C、H原子守恒列方程计算解答.
解答 解:浓硫酸增重为燃烧生成水的质量,其物质的量=$\frac{2.04g}{18g/mol}$=0.113mol,
固体质量的过氧化钠发生反应:2CO2+2Na2O2 =2Na2CO3+O2,固体质量增重等于与二氧化碳等物质的量的CO的质量,故CO的物质的量=$\frac{2.24g}{28g/mol}$=0.08mol,则原混合物中含有0.08mol碳原子,
设乙烷、丙烷的物质的量分别为xmol、ymol,
则:$\left\{\begin{array}{l}{6x+8y=\frac{2.04}{18}×2}\\{2x+3y=0.08}\end{array}\right.$,
解得:x=0.02、y=0.013,
混合气体中乙烷和丙烷的体积比=0.02mol:0.013mol=3:2,
故选:D.
点评 本题考查混合物计算,题目难度不大,关键是根据固体质量增重计算C原子物质的量,注意利用原子守恒进行解答,试题培养了学生的分析能力及化学计算能力.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:推断题
 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
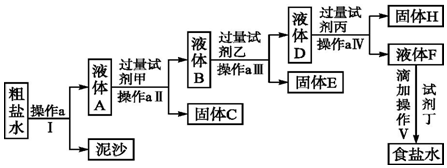
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能是第二周期的元素 | B. | a一定比b小 | ||
| C. | b-a+m+n一定等于16 | D. | Y只能是第三周期的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
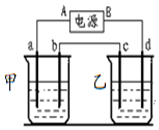 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;△\;}}{\;}$SO2↑+Cl2↑ |
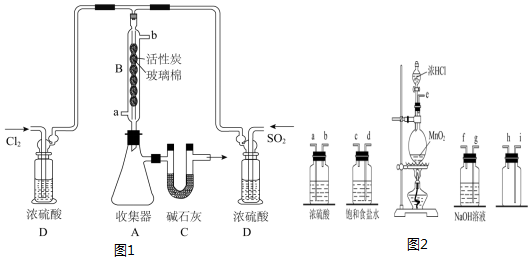
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com