
 (1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)
(1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)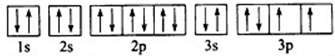 .其最高价氧化物对应的水化物的化学式是H2SO4.
.其最高价氧化物对应的水化物的化学式是H2SO4.分析 (1)这几种物质都是原子晶体,原子晶体熔沸点与键长成反比;
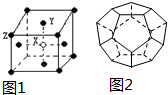
(2)该晶胞中X粒子个数是1、Y粒子个数=4×$\frac{1}{2}$、Z粒子个数=8×$\frac{1}{8}$,据此计算X、Y、Z粒子个数之比;
(3)根据原子核外电子排布式知,该原子核外电子数为16,原子中原子序数=核外电子数,其最高价氧化物的水化物是硫酸;
(4)分子晶体的构成微粒是分子,根据晶体构成微粒确定晶体类型.
解答 解:(1)这几种物质都是原子晶体,原子晶体熔沸点与键长成反比,键长:Ge-Ge>Si-Si>Si-C>C-C,所以晶体熔沸点金刚石>金刚砂>晶体硅>锗,故答案为:①>④>③>②;
(2)该晶胞中X粒子个数是1、Y粒子个数=4×$\frac{1}{2}$=2、Z粒子个数=8×$\frac{1}{8}$=1,所以X、Y、Z粒子个数之比=1:2:1,故答案为:1:2:1;
(3)根据原子核外电子排布式知,该原子核外电子数为16,所以该元素是S,原子中原子序数=核外电子数,S原子核外电子轨道表示式为 ,其最高价氧化物的水化物化学式为H2SO4,
,其最高价氧化物的水化物化学式为H2SO4,
故答案为:S; ;H2SO4;
;H2SO4;
(4)分子晶体的构成微粒是分子,该晶体是由C20分子构成的,所以属于分子晶体,故答案为:分子晶体.
点评 本题考查晶胞计算、核外电子排布、晶体类型判断、晶体熔沸点比较等知识点,为高考高频点,知道晶体熔沸点影响因素、常见晶体类型,难点是晶胞计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | C. | n(OH-)和c(H+) | D. | c(H+)和c(OH-)的乘积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是NaOH溶液 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图可表示水分解过程中的能量变化 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g)△H=-a kJ/mol, Ⅱ: 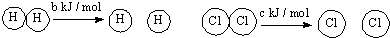 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
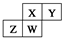 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com