
【题目】下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是
A. 甲苯B. 乙醇C. 丙烯D. 乙烯
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
(1)实验I 制取氯酸钾和氯水利用如图所示的实验装置进行实验.
(i)盛放浓盐酸的实验仪器名称是 .
(ii)A中发生反应的化学方程式是 .
(iii)B中生成氯酸钾的离子反应方程式是
(iv)若对调B和C装置的位置,(填“能”或“不能”)提高B中氯酸钾的产率,原因是 .
(2)实验II 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定.
乙方案:与足量Zn反应,测量生成的H2体积.
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样.
a.量取试样20.00ml,用0.10molL﹣1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00ml,则该次滴定所测的试样中盐酸浓度为;
b.重复滴定三次后获得实验结果.
②进行乙方案实验:装置如图所示(夹持器具已略去) .
.
(i)使Y形管中的残余清液与锌粒反应的正确操作是将转移到中,否则会造成实验结果偏低.
(ii)反应完毕,读取H2的体积,读数时应注意:a.冷却至室温b.c.视线与凹液面最低处相切.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类的说法正确的是
A. 二氧化碳、二氧化硅、一氧化碳均为酸性氧化物
B. 雾、稀豆浆、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、稀硫酸均属于电解质
D. 分子中含有两个氢原子的酸不一定是二元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用.合成G的一种路线如下: 
已知以下信息:
① ![]()
②1molB经上述反应可生成2molC,且C不能发生银镜反应.
③D属于单取代基芳烃,其相对分子质量为106
④F苯环上的一氯代物有2种
⑤ ![]()
回答下列问题
(1)由A生成B的反应类型为 , B中官能团的电子式为 .
(2)C的结构简式为 , D的一氯代物共有种.
(3)写出下列反应的化学方程式: E→F:
C+F→G:
(4)由苯和化合物C经如下步骤可合成N﹣异丙基苯胺. ![]()
反应条件1所选择的试剂为;反应条件2所选择的试剂为;I的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷是制备高纯度磷酸、烟幕弹、燃烧弹等的重要原料,工业上制备白磷的原理之一为4Ca5 (PO4)3F+21Si02+30C3P4+20GaSiO3+30CO↑+SiF4 , 回答相关问题:
(1)基态磷原子的价层电子排布图为 , 上述反应涉及的第二周期元素中第一电离能由大到小的顺序为(用元素符号表示).
(2)上述物质中,中心原子杂化轨道类型为sp3的分子有 , SiF4分子构型为 . 若不考虑C的晶体类型,则上述反应过程消失的晶体类型为 .
(3)碳、硅同一主族,CF4沸点比SiF4低的原因是;碳能形成π键而硅难形成π键的主要原因是 .
(4)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构,该化合物的分子式为 , 若其晶体中分子的堆积方式与干冰相同,则晶体中每个分子的配位数是 . 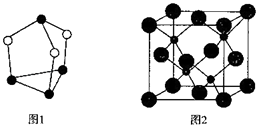
(5)碳、硅两种元素形成的一种高硬度化合物的晶胞如图2所示,若该化合物的密度为ρgcm3 , 晶胞参数为a pm,则阿伏伽德罗常数为mol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:过程如图,下列说法正确的是( ) 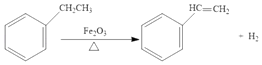
A.乙苯的同分异构体共有三种
B.可用Br2/CCl4鉴别乙苯和苯乙烯
C.乙苯和苯乙烯分子中均含有碳碳双健
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 第二周期元素从C到F,非金属性逐渐增强
B. 第三周期元素从Na到Cl,原子半径逐渐增大
C. HF、HCl、HBr、HI的热稳定性依次逐渐增强
D. LiOH、NaOH、KOH的碱性依次逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,20gH218O中含有中子数目为12NA
B.标准状况下,11.2LC2H6中含有极性键的数目为3.5NA
C.1LpH=3的CH3COOH溶液中,含有H+的数目大于10﹣3NA
D.1L1molL﹣1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com