
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素。
B元素原子的核外p电子数比s电子数少1。
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol
I4=10540kJ/mol
D原子核外所有p轨道全满或半满。
E元素的主族序数与周期数的差为4。
F是前四周期中电负性最小的元素。
G在周期表的第七列。
(1)已知BA5为离子化合物,写出其电子式__________________________________。
(2)B的基态原子中能量最高的电子,其电子云在空间有①_________个伸展方向,原子轨道呈②__________________形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为:
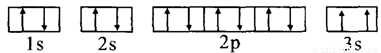
该同学所画的电子排布图违背了_________________________。
(4)G位于①_________族②________区,价电子排布式为③______________________。
(5)DE3分子中,中心原子的杂化方式为①_____________,其分子的立体构型为②_____________。
(6)F晶体的晶胞如下图所示,若设该晶胞的密度为ag·cm-3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为_____________cm。

(1) 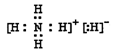 (2分) (2)3(2分) ,哑铃型(2分) (3)泡利原理(1分) (4)第VIIB(1分)
(2分) (2)3(2分) ,哑铃型(2分) (3)泡利原理(1分) (4)第VIIB(1分)
d(1分) ,3d54s2(1分) (5)sp3(1分) ,三角锥(1分) (6)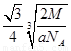 (3分)
(3分)
【解析】
试题分析:根据题目所给信息可知:A为H元素。B元素的核外电子排布为1s22s22p3。不可能为1s22s22p53s2。
所以B为N元素。根据C原子的第一至第四电离能的数据:可知C原子最外层2个电子易失去。结合题干
信息,主族元素,原子序数递增,可推知C为Mg元素。D原子核外所有p轨道全满或半满,可推知D的
核外电子排布为1s22s22p63s23p3或者为1s22s22p63s23p6,前面排布是P元素。后面是Ar元素(非主族元素)。E元素的主族序数与周期数的差为4,D是P元素,所以E只能在第三周期,所以为第VIIA族。E为Cl元素。F是前四周期中电负性最小的元素,电负性同周期从左到右逐渐增大,同主族从上到下逐渐减小。所以可推知F是K元素。G在周期表的第七列。所以为第VIIB族。为Mn元素。综上所述可推知各元素分别为:A是H,B是N,C是Mg,D是P,E是Cl,F是K,G是Mn。
(1)已知NH5为离子化合物,非金属离子化合物,显然应是铵盐,还有铵根离子,所以其电子式为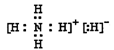 。
。
(2)N的核外电子排布为1s22s22p3,其基态原子中能量最高的电子应是p电子,其电子云在空间有3个伸展方向(x,y,z),原子轨道呈哑铃形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为:
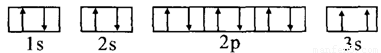
电子排布图中3s违背了泡利原理。同一轨道上不可能存在两个状态完全一样的电子。
(4)Mn价电子排布式为3d54s2,位于第VIIB族d区。
(5)PCl3分子中,根据VSEPR理论,价层电子对数目为4对,孤电子对数是1,所以中心原子的杂化方式为sp3,其分子的立体构型为三角锥。
(6)F晶体的晶胞如下图所示,若设该晶胞的密度为ag·cm-3,阿伏加德罗常数为NA,F原子的摩尔质量为M,根据晶胞结构可推断出,一个晶胞单元中含有2个金属原子。设晶胞边长为bcm,则有 b=4r,根据ρ=
b=4r,根据ρ=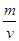 ,则有(
,则有(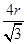 )3=
)3=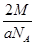 可推出r=
可推出r=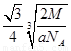 。
。

考点:物质结构中的相关概念:电子式的书写、电子排布图、排布式的书写、杂化形式的判断、立体构型、晶胞计算


科目:高中化学 来源: 题型:阅读理解
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |


 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
[物质结构与性质] 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1) 已知BA5 为离子化合物,写出其电子式
(2) B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
(3) 某同学根据上述信息,推断C基态原子的核外电子排布为,![]()
该同学所画的电子排布图违背了
(4) G位于 族 区,价电子排布式为
(5) DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6) 检验F元素的方法是 ,请用 原子结构的知识解释产生此现象的原因是
原子结构的知识解释产生此现象的原因是
(7) F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为 cm
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省太原市高三模拟(二)(理综)化学部分 题型:填空题
(15分)现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
⑴已知BA5 为离子化合物,写出其电子式 .
⑵B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为: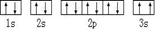
该同学所画的电子排布图违背了 .
⑷G位于 族 区,价电子排布式为 .
⑸DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
⑹检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
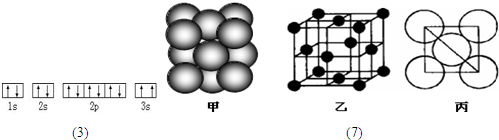
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本模式中的 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com