
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 |
| B.原子最外层电子数为1的元素一定处于周期表IA族 |
| C.氯化氢的沸点比氟化氢的沸点高 |
| D.同主族元素形成的氧化物的晶体类型均相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
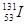 、
、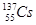 、
、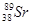 、
、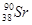 等放射性元素或物质发生泄露。下列说法错误的是
等放射性元素或物质发生泄露。下列说法错误的是A.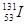 原子核内有78个中子 原子核内有78个中子 | B.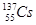 的质量数为137 的质量数为137 |
C.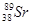 核外电子数为51 核外电子数为51 | D.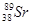 、 、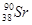 互为同位素 互为同位素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| a | | | |||||||||||||||
| b | | | | c | d | e | f | | |||||||||
| g | h | i | j | | k | l | m | ||||||||||
| n | | | | | | | o | |  | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
 素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。
素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。 l:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
l:786 kJ/mol。导致两者晶格能差异的主要原因_______________。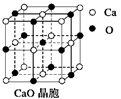
| A.NaN3与KN3结构类似,前者晶格能较小 |
B.金属钠的晶胞结构如图所示,每个晶胞平均分摊2个钠原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 结构和氖原子相同;短周期元素中B的金属性最强;C的原子核内质子数是B的次外层电子数的2倍。试推断:
结构和氖原子相同;短周期元素中B的金属性最强;C的原子核内质子数是B的次外层电子数的2倍。试推断:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com