



 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
 (2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答
(2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目:高中化学 来源: 题型:
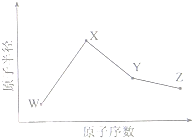 (2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:四川省成都外国语学校2011-2012学年高二上学期期中考试化学试题 题型:022
(1)中国古代四大发明之一——黑火药,它的爆炸反应为
2KNO3
+3C+S=A+N2+3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为________.
②在生成物中,A的化学键类型为________,含极性共价键的分子的中心原子轨道杂化类型为________属于________分子.
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________.
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布为________,Q2+的未成对电子数是________.
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H![]() Rx[CrCln(H2O)6-n]x++xH+
Rx[CrCln(H2O)6-n]x++xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成.将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为________.
(4)在铁和氧化铁的混合物15 g中加入稀硫酸150 mL,标准状况下放出氢气1.68 L,同时铁和氧化铁均无剩余.向溶液中滴入KSCN未见颜色变化.为了中和过量的硫酸,且使Fe2+完全转化为氢氧化亚铁,共消耗3 mol/L的氢氧化钠溶液200 mL,则原硫酸的物质的量浓度为________mol/L.
查看答案和解析>>
科目:高中化学 来源:2011年普通高等学校招生全国统一考试化学卷(安徽) 题型:填空题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。

(1) X位于元素周期表中第 周期第 族;W的基态原子核外有 个未成对电子。
(2)X的单质子和Y的单质相比,熔点较高的是 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 。
(4)在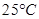 、101 kPa下,已知Y的气态化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是
。
、101 kPa下,已知Y的气态化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是
。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
 A+ N2↑ +3CO2↑
A+ N2↑ +3CO2↑ 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com