
| A. | 加入氢氧化钠溶液,产生蓝色淀,一定有Cu2+ | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| D. | 加入过量盐酸,振荡、静置,再滴入氯化钡溶液,有白色沉淀产生,一定有SO42- |
分析 A.蓝色沉淀为氢氧化铜;
B.该气体可能为二氧化碳,能够与稀盐酸反应生成二氧化碳的离子不一定为碳酸根离子,可能为碳酸氢根离子;
C.沉淀不一定为碳酸钙,也可能为碳酸钡等;
D.先加入盐酸,可排除其它离子的干扰.
解答 解:A.蓝色沉淀为氢氧化铜,可说明一定有Cu2+,故A正确;
B.某固体在加入稀盐酸后产生了无色无味且能使澄清石灰水变浑的气体,该气体为二氧化碳,该固体中可能含有HCO3-,不一定含有CO32-,故B错误;
C.沉淀不一定为碳酸钙,也可能为碳酸钡等,不一定含有Ca2+,故C错误;
D.先加入盐酸,可排除其它离子的干扰,加入氯化钡生成沉淀,一定为硫酸钡,则含有硫酸根离子,故D正确.
故选AD.
点评 本题考查常见离子的检验方法,为高频考点,把握离子检验的试剂、现象与结论为解答的关键,侧重分析与应用能力的考查,注意检验时排除干扰离子,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| 共价键 | 键能 | 共价键 | 键能 |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-C1 | 330 | H-Se | 314 |
| A. | H2(g)→2H(g)△H=+436kJ/mol | |
| B. | 键长越短,共价键越牢固 | |
| C. | 相同条件下CH3F比CH3C1更易发生水解反应 | |
| D. | 相同压强下,H2S的沸点比H2Se的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
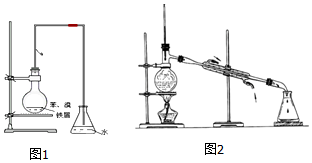 (1)某同学设计如图1装置制取少量溴苯,写出实验室制取溴苯的化学方程式
(1)某同学设计如图1装置制取少量溴苯,写出实验室制取溴苯的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
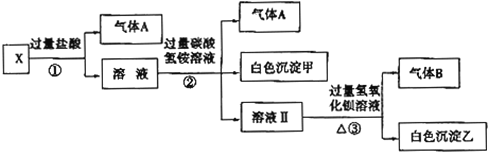
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2-m | B. | a+m+n | C. | 2n+3a-m | D. | 2+a+2n-m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
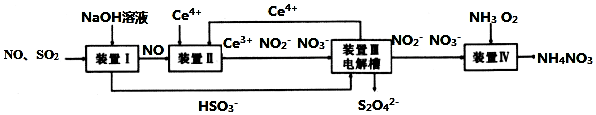

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向正反应方向移动 | B. | 向逆反应方向移动 | ||
| C. | 达到平衡 | D. | 无法判断移动方向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com