
| T/K | 2.98 | 398 | 498 |
| ƽ�ⳣ��K | 2.44��10-6 | K1 | K2 |
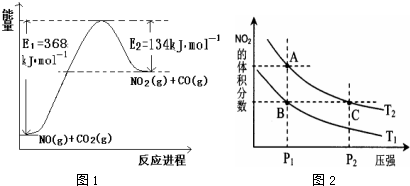
���� ��1�����������仯ͼ����Ӧ�ȵ�������Ӧ�Ļ�ܼ�ȥ�淴Ӧ�Ļ�ܣ�
��2���ٸ��������¶�ƽ�����ȷ����ƶ��Լ�ƽ�������ƶ�ƽ�ⳣ������
�ڷ�Ӧ�������������ķ�Ӧ��
��ֱ�ӱ�־�������ʹ�ϵ������Ӧ�������淴Ӧ������ȣ��ڷ�Ӧ��ϵ�и����ʵİٷֺ������ֲ��䣮
��ӱ�־���ٻ���������ѹǿ��������������ʵ�������ʱ��ĸı���ı䣨m+n��p+q�����ڸ����ʵ�Ũ�ȡ����ʵ�������ʱ��ĸı���ı䣻�۸�����������������ķ�ѹ����ʱ��ĸı���ı䣻
�����ݻ�ѧƽ������ʽ��ʽ���㣬����ѹǿ֮�ȵ����������ʵ���֮�ȣ�ת����=$\frac{������}{��ʼ��}$��100%��
��3����Һ��pH=-lgc��H+����CH3COOH��HCl��ҺΪ�ᣬˮ�������c��H+��������Һ��c��OH-����
��4��a��A��C���㶼�ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죻
b��A��C���㶼�ڵ������ϣ�ƽ�ⳣ��ֻ���¶��йأ�
c��A��C���㶼�ڵ������ϣ�ѹǿ����ƽ��������������ٵķ����ƶ���
d���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���
��� �⣺��1���÷�Ӧ���ʱ��H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol�������Ȼ�ѧ����ʽΪNO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ•mol-1��
�ʴ�Ϊ��NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ•mol-1��
��2����2NH3��g��?N2��g��+3H2��g����H��0��Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����������K1��K2��
�ʴ�Ϊ������
�ڷ�Ӧ2NH3��g��?N2��g��+3H2��g���������������ķ�Ӧ����Ӧ���ر��S��0��
�ʴ�Ϊ������
��a��ƽ��ʱ��Ӧ������и���ֵĺ������ֲ��䣬��������N2��H2��NH3��Ũ��֮�Ȳ�һ��ΪΪ1��3��2�����Բ�����Ϊƽ��ı�־����a����
b��ƽ��ʱ��ͬ���ʱ�ʾ����֮�ȵ���ϵ��֮��˵������ƽ�⣬��3v��NH3����=2v��H2����˵����Ӧ�ﵽƽ�⣬2v��NH3����=3v��H2������˵����Ӧ�ﵽƽ��״̬����b����
c����Ӧǰ�������������䣬�������ʵ������������ڻ������ƽ����Է����������ֲ���˵����Ӧ�ﵽƽ��״̬����c��ȷ��
d����Ӧǰ��������������䣬������������䣬�����ܶȲ��䣬���Ի��������ܶȱ��ֲ��䲻����Ϊƽ��ı�־����d����
��ѡ��c��
�ʴ�Ϊ��c��
��һ���¶��£���1L�ܱ������г���1mol N2��3mol H2��������Ӧ���������ݻ��㶨��10min�ﵽƽ��ʱ���������ѹǿΪԭ����$\frac{9}{10}$�����ݻ�ѧƽ������ʽ��ʽ���㣬�赪���������ʵ���Ϊx��
N2+3H2=2NH3
��ʼ����mol�� 1 3 0
�仯����mol�� x 3x 2x
ƽ������mol�� 1-x 3-3x 2x
�������ѹǿΪԭ����$\frac{9}{10}$����1-x+3-3x+2x=$\frac{9}{10}$����1+3��
x=0.2mol
��N2��ת���ʦ���N2��=$\frac{0.2mol}{1mol}$��100%=20%��
�ʴ�Ϊ��20%��
��3��CH3COOHΪ�ᣬpH=-lgc��H+����pH����5��CH3COOH��Һ��HCl��Һ��C��H+��=1.0��10-5mol/L��25��ʱ��Kw=c��OH-����c��H+��=10-14����Һ�е�c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-5}}$=1.0��10-9mol/L��pH����5��CH3COOH��Һ��HCl��Һ����������ԴΪ��ĵ����ˮ�ĵ��룬������Һ��ˮ�������������Ũ�ȵ�������������Ũ�ȣ�������ˮ�������C��H+����1.0��10-9mol/L��������Һ����ˮ���������c��H+��֮��Ϊ1��1��
�ʴ�Ϊ��1��1��
��4��a��A��C���㶼�ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죬�������ʣ�C��A����a����
b��A��C���㶼�ڵ������ϣ�ƽ�ⳣ��ֻ���¶��йأ����Ի�ѧƽ�ⳣ����A=C����b����
c��A��C���㶼�ڵ������ϣ�C��ѹǿ���ߣ�ѹǿ����ƽ��������������ٵķ����ƶ������淴Ӧ�����ƶ���N2O4��ת���ʽ��ͣ���������N2O4��ת���ʣ�A��C����c��ȷ��
d���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ���NO2�������������������״̬B��״̬A�������ü��ȵķ�������d��ȷ��
��ѡ��cd��
�ʴ�Ϊ��cd��
���� ������Ҫ�������Ȼ�ѧ����ʽ����д����ѧƽ�ⳣ������ѧƽ���ͼ��ƽ��״̬���жϵȣ���Ŀ�Ѷ��еȣ����ض�ѧ�������Ŀ��飮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2SiO3��SO2 | B�� | Al2��SO4��3�� ��ˮ | C�� | FeI2��Cl2 | D�� | NaHCO3��Ca��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 78gNa2O2���庬�е�������Ϊ4NA | |
| B�� | 22.4L��ϩ�к��еķ�����ΪNA | |
| C�� | �ö��Ե缫���NaCl��Һ��ÿ����agNaOHʱ����·��ͨ���ĵ��Ӹ���ΪaNA | |
| D�� | 1molSiO2������Si-O����Ϊ4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������̼�Ľṹʽ��O=C=O | B�� | �����ӵĽṹʾ��ͼ�� | ||
| C�� | �����ӵĵ���ʽ��Ca2+ | D�� | �廯����ӵĵ���ʽ��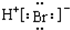 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������C2H5OH��������H2SO4�����ӻ������Һ��������ʣ� | |
| B�� | CO2���ǵ���ʣ���NH4Cl����Σ���HNO3�������ᣩ��NaOH��ǿ����ʣ� | |
| C�� | HCl�����ۻ������CH3COOH�����ᣩ��Na2O2�������������CH3I��±������ | |
| D�� | NO2�������������CH3CHO������CO������CH3COOCH3������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | x=0.4a��2Fe2++Cl2�T2Fe3++2Cl- | |
| B�� | x=0.6a��2Br-+Cl2�TBr2+2Cl- | |
| C�� | x=2a��2Fe2++2Br-+2Cl2�TBr2+2Fe3++4Cl- | |
| D�� | x=1.5a��2Fe2++4Br-+3Cl2�T2Br2+2Fe3++6Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
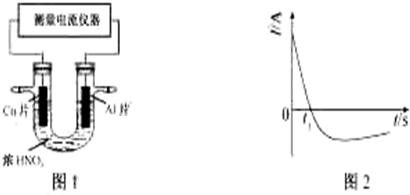
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com