
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响。设计实验方案如下:
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小。
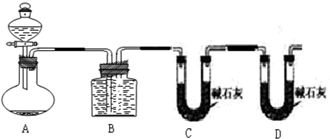
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中

(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
|
序号 |
A溶液 |
B溶液 |
|
① |
2 mL 0.1mol/LH2C2O4溶液 |
4 mL0.01mol/LKMnO4溶液 |
|
② |
2 mL 0.2mol/LH2C2O4溶液 |
4 mL0.01mol/LKMnO4溶液 |
(1)如何检查该装置的气密性: 。
(2)写出当锥形瓶中加入A溶液后发生的反应的离子方程式(提示:H2C2O4为弱酸): 。
(3)该实验探究的是 对化学反应速率的影响。分析所给实验仪器,实现该实验目的还欠缺的仪器: 。你将如何比较①②组化学反应速率大小?你的操作是 。
乙组:通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢。
25℃时,40 mL 0.001mol/LKMnO4与38 mL0.1 mol/LH2C2O4和2 mL2.38mol/LH2SO4混合液共80 mL中KMnO4的浓度及对应时段的平均反应速率数据:
|
时间(min) |
4 |
8 |
12 |
16 |
21 |
22 |
23 |
24 |
25 |
|
c(KMnO4)(10-4mol/L) |
4.58 |
4.02 |
3.36 |
2.25 |
0.72 |
0.43 |
0.23 |
0.16 |
0.13 |
|
υ(KMnO4) (10-4mol/(L·min) |
υ |
0.14 |
0.17 |
0.28 |
0.32 |
0.29 |
0.20 |
0.07 |
0.03 |
(4)完成上表中υ= ×10-4mol/(L·min)。
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大。
①你认为引起该反应速率增大的因素是 。
②请设计实验证明你的观点,写出实验步骤及结论:
|
实验步骤及结论:
|
(共17分)
(1)关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好。(2分)
(2)2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O(2分)
(3)浓度(1分) 秒表(1分)
比较在该环境中,相同时间收集到的气体体积,多的反应速率快(或比较在该环境中,比较收集相同体积气体所用时间,越短速率越快)(2分)
(4)0.11(3分)
①反应过程中产生了催化剂加快了反应速率(如果答生成的Mn2+对反应有催化作用也给分)(2分:
(或其他合理答案也给分)
|
实验步骤及结论:(答案合理即可) 实验步骤:首先,取两支试管分别加入等体积上述酸性KMnO4溶液;接下来,向其中一支试管中加入少许MnSO4固体;最后,同时分别向两支试管中加入等体积的上述H2C2O4溶液,观察两支试管中颜色褪去的时间长短。(2分) 结论:若加有MnSO4固体试管褪色时间短,则证明是生成的Mn2+作催化剂。(2分) |
【解析】
试题分析:本题以课本实验为基础,探究影响化学反应速率的因素,首先应该联系课本知识,了解影响化学反应速率的因素有哪些以及氧化还原知识,实验基本操作等基础知识,然后运用恰当的方法进行解题。
(1)考查气密性的检查,在这个相对密封的体系,打开分液漏斗,开始用液体流下,后停止,并保持,说明气密性良好或通过活塞的推动,也可判断;
(2)氧化还原反应方程式的书写
(3)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;
(4)根据相关数据可以计算出速率的大小;从数据看出反应的速率先增大后减小,故可以考虑催化剂的影响。
考点:以探究实验为基础,考查影响化学反应速率的因素、化学实验基本操作、氧化还原反应基础知识等。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲组用沉淀分析法,把一定量的混合物溶解后加入足量的CaCl2,然后过滤,他们在用过滤装置操作时,还要进行的一项操作是______________。在整个实验过程中,使用天平至少要_________次。
(2)乙组用气体分析法,把一定量的混合物与足量盐酸反应后,然后用图15-24装置测定产生的CO2气体的体积,请分析广口瓶中的溶液是_____________,该装置测定的气体体积是否准确,说明理由______________________________________________________________。
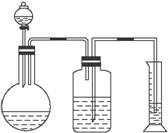
图15-24
(3)请你再设计一个与甲、乙组操作不同的实验方法,测定混合物中的Na2CO3含量。方法是____________________________________________________________________。
用到的主要试剂是_______________(至少两种),用到的仪器主要是___________________(至少两件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲组用沉淀分析法,把一定量的混合物溶解后加入足量的CaCl2,然后过滤,他们在用过滤装置操作时,还要进行的一项操作是____________________________。在整个实验过程中,使用天平至少要_______次。
(2)乙组用气体分析法,把一定量的混合物与足量的盐酸反应后,然后用图2-1-3所示装置测定产生的CO2气体的体积,请分析广口瓶中的溶液是_______,该装置测定的气体体积是否准确,说明理由:__________________________________________。
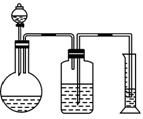
图2-1-3
(3)请你再设计一个与甲、乙组操作不同的实验方法,测定混合物中的Na2CO3含量。方法是____________________________。用到的主要试剂是_______ (至少两种),用到的仪器主要是_______________________________________________________________(至少两件)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市高三9月月考化学试卷(解析版) 题型:实验题
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。
确定CaCl2溶液是否过量的方法是____________________________________,
判断沉淀是否洗净的操作是____________________________________________。
(2)乙组:气体分析法
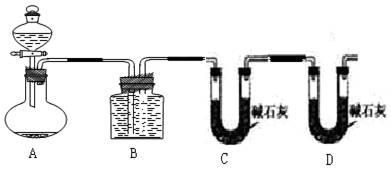
用如图装置进行实验,为了减少误差,分液漏斗中应该用____________溶液,B中应该用_____________________溶液,选用该溶液后实验结果还是不准,请问是_____________,(填“偏高”、“偏低”或“无影响”)原因是______________________________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物中Na2CO3的含量。
方案:__________________________________。
用到的主要试剂:_____________________________________。
用到的玻璃仪器:_____________________________________(至少2件)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com