
化学在生产和生活中有着重要的应用。下列说法不正确的是
A.可溶性铁盐或铝盐可用于水的净化
B.电解MgCl2溶液可制得金属镁
C.在海轮的外壳镶上锌块,可减缓船体的腐蚀速率
D.“开发利用新能源”、“汽车尾气催化净化”都能提高空气质量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年江苏省高二上第二次质检化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.氯化钠的电子式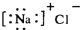
B.乙烯的结构式 H-C=C-H
C.磷原子的结构示意图 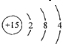
D.乙酸的分子式 C2H4O2
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量, Y的转化率降低
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第五次月考化学试卷(解析版) 题型:选择题
能说明溶液呈中性的最可靠依据是
A.pH=7 B.c(H+)=c(OH-)
C.pH试纸不变色 D.石蕊试液不变色
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高级中学高三上第二次月考理综化学试卷(解析版) 题型:填空题
[化学选修2——化学与技术](15分)
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组,将一批废弃的线路析简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜和硫酸铝晶体的路线:
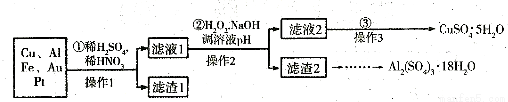
请回答下列问题:
(1)第①步Cu与酸反应的所有的离子方程式为_______;得到滤渣1的主要成分为___________。
(2)第②步加H2O2的作用是___________,使用H2O2的优点是___________,调溶液pH的目的是使________________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(S04)3•18H2O,探究小组设计了三种方案:
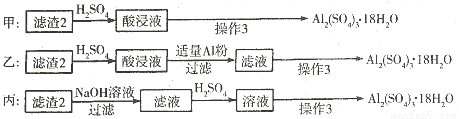
上述三种方案中,________方案不可行,原因是________________从原子利用率角度考虑,__________方案更合理。
查看答案和解析>>
科目:高中化学 来源:2016届西藏拉萨中学高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同;
B.同温同压下,反应H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH不同;
C.已知:①2H2(g)+O2(g) == 2H2O(g) ΔH=-a kJ/mol,
②2H2(g)+O2(g) == 2H2O(l) ΔH=-b kJ/mol,则a>b;
D.已知:①C(s,石墨)+O2(g) == CO2(g) ΔH=-393.5 kJ/mol,
②C(s,金刚石)+O2(g) == CO2(g) ΔH=-395.0 kJ/mol,则
C(s,石墨) == C(s,金刚石) ΔH=+1.5 kJ/mol;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:填空题
实验室需要90mL 2.0 mol·L-1的Na2CO3溶液,现用无水碳酸钠粉未配制;请回答下列问题:
(1)请先通过计算,再确定称取 g无水碳酸钠。
(2)下列仪器中,不会用到的是
A.50mL容量瓶; B.100mL容量瓶; C.玻棒;
D.100mL量筒; E.托盘天平; F.药匙
(3)若要实施配制,除上述仪器外,尚缺的仪器是 。
(4)容量瓶在使用前必须进行的操作是 。
(5)配制过程简述为以下各步:其正确的操作顺序为 (填各步骤序号)。
A.冷却至室温; B.洗涤并移液; C.称取; D.溶解;
E.摇匀装瓶; F.定容; G.移液
(6)在配制过程中,下列情况对浓度有何影响?
① 容量瓶用蒸馏水洗净后,没等到干燥,就移入溶液定容,则所配溶液的浓度
(填“偏高”或“偏低”或“无影响”,下同);
② 转移溶液时,不小心有溶液溅在瓶外,则所配溶液的浓度
③定容时若俯视刻度线,则所配溶液的浓度
④若在滴加蒸馏水时,不慎超过了刻度线,则所配溶液的浓度 。
此时应如何处理? 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高一上12月月考化学卷(解析版) 题型:选择题
硫酸亚铁在高温下分解的方程式为:2FeSO4  Fe2O3+SO2↑+SO3↑。若将反应所得的气体混合物通入BaCl2溶液(已知SO3+ H2O ═H2SO4),将得到
Fe2O3+SO2↑+SO3↑。若将反应所得的气体混合物通入BaCl2溶液(已知SO3+ H2O ═H2SO4),将得到
A.BaSO3与BaSO4沉淀 B. BaSO3沉淀
C.BaSO4沉淀 D.无法得到沉淀物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:填空题
(1)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为aL,达到平衡时,V(B)=0.8aL,
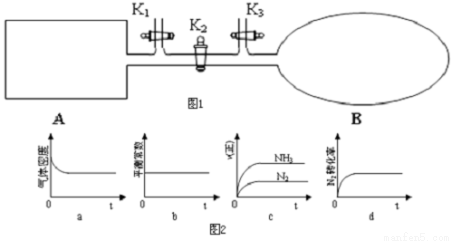
①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。
②A、B中N2转化率的关系:α(A) ___α(B)(填“>”、“<”或“=”);
③打开K2,一段时间又达到平衡时,B的体积为_____L(连通管中气体体积不计)
(2)某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究,在25℃时,弱酸HA在水中部分电离,当HA浓度为4.0×10-3mol•L-1时,其电离度为0.30;在苯中部分发生双聚,生成(HA)2.该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=c(HA)B/c(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
25℃平衡体系 | HA起始总浓度 |
在水中,HA | 4.0×10-3mol•L-1 |
在苯中,2HA | 5.0×10-3mol•L-1 |
则25℃,在苯体系中HA的转化率为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com