

| 操作步骤 | 现象 | 结论 |
| 取少量氯化铵产品于试管底部,加热 | 如果试管底部没有固体剩余 | 表明氯化铵产品纯净 |
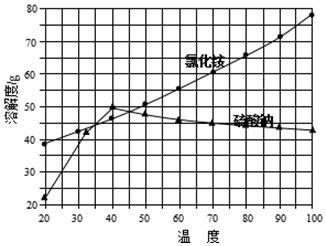
分析 将氯化钠和硫酸铵混合溶解,蒸发浓缩,根据溶解度曲线可知,在温度较高时,硫酸钠溶解度较小,所以趁热过滤可得硫酸钠固体,溶液中则主要为氯化铵,过滤得氯化铵溶液,将氯化铵溶液冷却结晶,过滤得氯化铵固体,经洗涤干燥得氯化铵产品,
(1)硫酸铵和氯化钠相互交换离子生成硫酸钠和氯化铵;
(2)根据Cl元素守恒计算NaCl的质量;
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还需要蒸发皿、玻璃棒、烧杯;
(4)从溶解度曲线判断硫酸钠和氯化铵的溶解度变化特点分析,在35-45℃时,氯化铵的溶解度小于硫酸钠的溶解度;
(5)氯化铵分解生成氯化氢和氨气,根据固体加热是否有剩余固体确定氯化铵是否除净.
解答 解:将氯化钠和硫酸铵混合溶解,蒸发浓缩,根据溶解度曲线可知,在温度较高时,硫酸钠溶解度较小,所以趁热过滤可得硫酸钠固体,溶液中则主要为氯化铵,过滤得氯化铵溶液,将氯化铵溶液冷却结晶,过滤得氯化铵固体,经洗涤干燥得氯化铵产品,
(1)硫酸铵和氯化钠相互交换离子生成硫酸钠和氯化铵,反应方程式为(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4,
故答案为:(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4;
(2)10.7g NH4Cl的物质的量为$\frac{10.7g}{53.5g/mol}$=0.2mol,根据Cl元素守恒,需要NaCl的物质的量也为0.2mol,质量为0.2mol×58.5g/mol=11.7g,
故答案为:11.7;
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还需要蒸发溶液的蒸发皿、盛放晶体的烧杯、搅拌用的玻璃棒,
故答案为:蒸发皿、烧杯、玻璃棒;
(4)根据硫酸钠的溶解度曲线不难看出,在低于40℃时,硫酸钠的溶解度随温度的升高而增大,高于40℃时硫酸钠的溶解度随温度的升高而减小;由两物质的溶解度曲线不难看出,只有在35~45℃时,氯化铵的溶解度小于硫酸钠的溶解度,
故答案为:35℃;
(5)加热条件下氯化铵分解生成氨气和氯化氢,如果固体完全是氯化铵,则加热后没有固体剩余,如果有固体剩余就证明氯化铵不纯净,所以其检验方法为:取少量氯化铵产品于试管底部,加热,如果试管底部没有固体剩余,就说明氯化铵纯净,
故答案为:加热;如果试管底部没有固体剩余.
点评 本题考查物质制备,为高频考点,侧重考查学生实验操作、图象分析能力,明确化学反应原理、物质性质及其差异性是解本题关键,知道氯化铵的检验方法,题目难度不大.


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用工业盐(NaNO2)作咸味调味品 | |
| B. | 用硫磺熏制银耳,使它颜色更白 | |
| C. | 食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐 | |
| D. | 将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
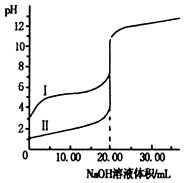 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A. | I、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | pH=7时,两种酸所消耗NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00mL时,c(Cl一)<c(CH3COO一) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
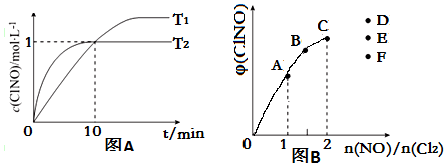
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-7 |
| ③ | 0.90 | 3.24×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.| 实验现象 | 结 论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com