
【题目】下列括号中的分离方法运用得当的是
A. 植物油和水(蒸馏) B. 水溶液中的食盐和碘(分液)
C. CaCO3和CaCl2(溶解、过滤、蒸发) D. 自来水中的杂质(萃取)
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀盐酸处理后沉淀量减少到4.66g,并有气体放出。试计算∶
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度分别是多少?__________、_________________1.0 mol/L 0.4 mol/L
(2)产生的气体在标准状况下的体积。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中,下列方法或应急措施不科学的是
A. 利用灼烧法区别羊毛织物和棉织物
B. 用食醋浸泡有水垢的水壶以清除其中的水垢
C. 厨房内发生了燃气泄漏先打开排气扇通风再关掉气阀
D. 将一氧化碳中毒者移到通风处抢救
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p 轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。
据此请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是 (填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
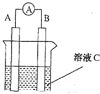
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向盛有①紫色石蕊溶液 ②NaOH溶液 ③品红溶液 ④酸性高锰酸钾溶液的试管中通入SO2气体。
(1)试管①中的现象:___________发生反应的化学方程式是:_________________。
(2)试管②中发生反应的化学方程式是:_____________________,如果通入过量的SO2,则发生反应的化学方程式为:_______________________________。
(3)试管③中的现象:________,如将吸收SO2后的该溶液加热,现象:______________。
(4)试管④中的现象:____________________。
(5)上述实验中,SO2表现出酸性氧化物性质的是___________(填试管标号,下同),SO2表现出漂白性的是___________。SO2表现出还原性的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列有关说法正确的是( )
A. 英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
B. 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放人生石灰
C. 二氧化硫有毒,严禁将其添加到任何食品和饮料中
D. 泡沫灭火器中用的是小苏打和硫酸铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从深海鱼中提取出来的一种不饱和脂肪酸被称为“脑黄金”,其中只含碳、氢、氧三种元素。其蒸汽密度是甲烷的24 倍,其中碳的质量分数为81.25%,它的一个分子中只有一个羧基。请通过计算确定该“脑黄金”的分子式。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是理想的清洁能源,资源丰富。以太阳能为热源分解 Fe3O4 ,经由热化学铁氧化合物循环分解水制H2 的过程如下:
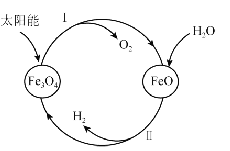
(1)过程Ⅰ:![]()
①将O2分离出去,目的是提高Fe3O4的 。
②平衡常数K 随温度变化的关系是 。
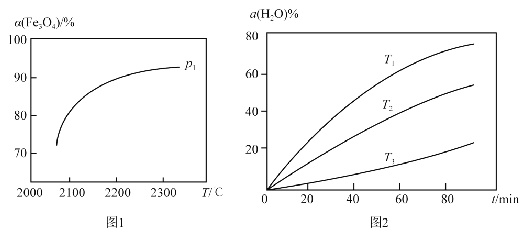
③在压强 p1下, Fe3O4的平衡转化率随温度变化的![]() (Fe3O4) ~ T 曲线如图 1 所示。若将压强由p1增大到p2 ,在图1 中画出 p2 的
(Fe3O4) ~ T 曲线如图 1 所示。若将压强由p1增大到p2 ,在图1 中画出 p2 的![]() (Fe3O4) ~ T 曲线示意图。
(Fe3O4) ~ T 曲线示意图。
(2)过程Ⅱ的化学方程式是 。
(3)其他条件不变时,过程Ⅱ在不同温度下, H2O的转化率随时间的变化![]() (H2 O) ~ t曲线如图2 所示。比较温度T1 、T2 、T3的大小关系是 ,判断依据是 。
(H2 O) ~ t曲线如图2 所示。比较温度T1 、T2 、T3的大小关系是 ,判断依据是 。
(4)科研人员研制出透氧膜(OTM) ,它允许电子、O2-同时透过,可实现水连续分解制H2。工作时,CO、H 2O分别在透氧膜的两侧反应。工作原理示意图如下:
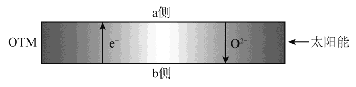
H2O在 侧反应(填“ a ”或“ b ”),在该侧H2O释放出H2的反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com