
| A.原子的价电子排布式是7s27p5 | B.最高化合价是+7价 |
| C.其单质是双原子分子,常温常压下呈气态 | D.阴离子具有很强的还原性 |
科目:高中化学 来源:不详 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、—CH3、
、—CH3、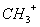 都是重要的有机反应中间体,有关它们的说法正确的是_________________
都是重要的有机反应中间体,有关它们的说法正确的是_________________| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
D.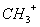 中的碳原子采取sp2杂化,所有原子均共面 中的碳原子采取sp2杂化,所有原子均共面 |
 和一个
和一个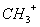 结合均可得到CH3CH3
结合均可得到CH3CH3查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.质子数:c>d | B.离子的还原性:Y2->Z- |
| C.氢化物的稳定性:H2Y>HZ | D.原子半径:X<W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有① | B.②④⑥ | C.①③④ | D.只有⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com