
| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
分析 A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大,A元素原子的核外p电子总数比s电子总数少1,则A为N元素;B原子核外所有p轨道全满或半满,则B原子核外有15个电子,为P元素;
C元素的主族序数与周期数的差为4,则其主族序数为7,为Cl元素;
D是前四周期中电负性最小的元素,则D是K元素;
E在周期表的第十一列,则Cu元素;
(1)A基态原子中能量最高的电子是2p能级上的电子,P电子电子云在空间有3个方向;
(2)E是Cu元素,位于周期表的第四周期第IB族,位于ds区,其基态原子几个电子就有几种运动状态;
(3)PCl3中心原子的价层电子对个数是4且含有1个孤电子对,根据价层电子对互斥理论判断P原子杂化方式及该分子空间构型;K元素的检验方法是焰色反应;
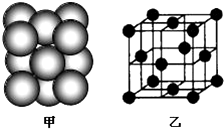
(4)该晶胞中每个Cu原子配位数=3×8÷2;
Cu单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积;
该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该晶体的密度=$\frac{m}{V}$.
解答 解:A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大,A元素原子的核外p电子总数比s电子总数少1,则A为N元素;B原子核外所有p轨道全满或半满,则B原子核外有15个电子,为P元素;
C元素的主族序数与周期数的差为4,则其主族序数为7,为Cl元素;
D是前四周期中电负性最小的元素,则D是K元素;
E在周期表的第十一列,则Cu元素;
(1)A基态原子中能量最高的电子是2p能级上的电子,P电子电子云在空间有3个方向,原子轨道为纺锤形,故答案为:3;纺锤形;
(2)E是Cu元素,位于周期表的第四周期第IB族,位于ds区,其基态原子几个电子就有几种运动状态,该原子有29个电子,所以其基态原子有29种运动状态,故答案为:第四周期第IB族;ds;29;
(3)PCl3中心原子的价层电子对个数是4且含有1个孤电子对,根据价层电子对互斥理论判断P原子杂化方式及该分子空间构型分别为sp3、三角锥形;K元素的检验方法是焰色反应,
故答案为:sp3;三角锥形;焰色反应;
(4)该晶胞中每个Cu原子配位数=3×8÷2=12;
Cu单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积;
该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该晶胞中面上处于对角线的3个原子近挨着,该晶胞体积=(2$\sqrt{2}$d)3cm3,晶体的密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}d)^{3}}$g•cm-3=$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3,
故答案为:12;面心立方堆积;$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$.
点评 本题考查位置结构和性质,为高频考点,涉及晶胞计算、原子杂化发生判断、微粒空间构型判断、元素推断等知识点,侧重考查学生分析判断、计算及空间想象能力,难点是晶胞计算,注意(4)题哪些原子紧挨着,为易错点.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体一定是CH4和C2H4 | |
| B. | 混合气体中一定有CH4,可能含有C2H4 | |
| C. | 混合气体中一定含有CH4,可能含有C2H6 | |
| D. | 混合气体中可能含有C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p 电子数 |
| X | 元素的原子半径是第三周期主族元素中最大的 |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
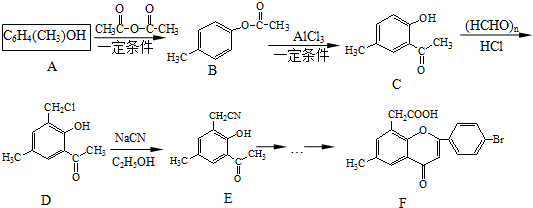
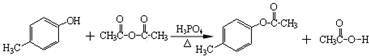 .
.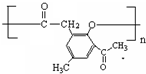 .
.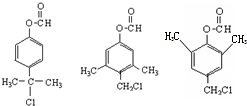 .
.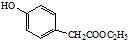 )是一种重要的医药中间体.完成以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).
)是一种重要的医药中间体.完成以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).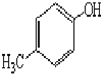 $→_{一定条件}^{Cl_{2}}$
$→_{一定条件}^{Cl_{2}}$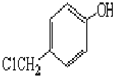
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaHSO4固体,ν(H2)不变 | B. | 加入少量水,ν(H2)减小 | ||
| C. | 加入CH3COONa固体,ν(H2)不变 | D. | 滴加少量CuSO4溶液,ν(H2)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com