
A、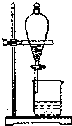 分离CH3COOC2H5和饱和碳酸钠溶液 |
B、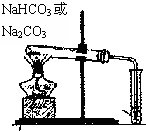 鉴别碳酸钠和碳酸氢钠 |
C、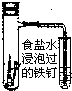 铁的吸氧腐蚀实验 |
D、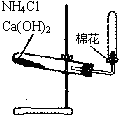 实验室制备氨气 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸 ②用酒精洗涤粘有硫粉的试管 ③用托盘天平称量10.1g氯化钠晶体 ④实验中不慎将手指划破,可立即用FeCl3溶液止血 ⑤用瓷坩埚熔融NaOH ⑥用饱和NaHCO3溶液除去CO2中的少量SO2
A.①②③④ B.③④⑥ C.③④⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )| A、假蜜环菌甲素可以发生消去反应 |
| B、1 mol假蜜环菌甲素可与 6 molH2发生加成反应 |
| C、假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 |
| D、假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子晶体中,分子间作用力越大分子越稳定 |
| B、分子晶体都是由共价分子构成的 |
| C、离子晶体中可能含有共价键 |
| D、原子晶体中只存在非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
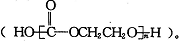 下列有关说法不正确的是( )
下列有关说法不正确的是( )| A、乙二醇可作汽车抗冻液 |
| B、减少CO2的排放可防止酸雨 |
| C、该塑料是一种有机高分子材料 |
| D、链节上酯基的水解有利于降解发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
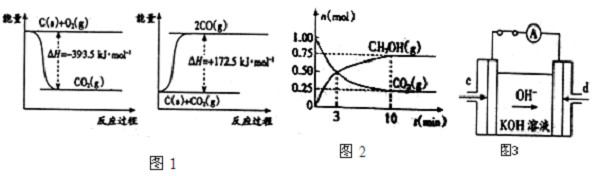
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.61×10-1 | Kb=1.77×10 |
| Kw |
| Kb |
| Kw |
| Ka2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏和石油的分馏均属于化学变化 |
| B、将碘酒滴在鸡蛋清中,可观察到鸡蛋清显蓝色 |
| C、乙酸的酯化反应和苯的硝化反应属于同种反应类型 |
| D、乙烯能够发生加成反应,结构简式为CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com