
| A. | 化合物中一定没有非极性键 | |
| B. | 单质中不可能含有离子键 | |
| C. | 金属元素与非金属元素间形成的键均是离子键 | |
| D. | CO2、CH4分子中每个原子最外层均形成了8电子结构 |
分析 A.化合物中可能含有非极性键;
B.单质中可能存在共价键,也可能无化学键;
C.金属元素和非金属元素可能形成共价键;
D.对于ABn型共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,含H元素的化合物一定不满足8电子结构.
解答 解:A.化合物中可能含有非极性键,如过氧化钠、过氧化氢,故A错误;
B.单质中可能存在共价键,如氢气,也可能无化学键,如氦气,不可能含有离子键,故B正确;
C.金属元素和非金属元素可能形成共价键,如氯化铝,故C错误;
D.CH4中分子中H原子最外层满足2电子结构,故D错误;
故选B.
点评 本题考查化学键,侧重考查基本概念,明确物质的构成微粒及微粒之间作用力即可解答,采用举例法分析解答,易错选项是C.


科目:高中化学 来源: 题型:解答题
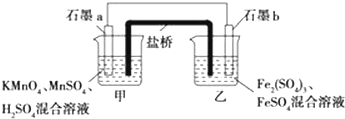
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
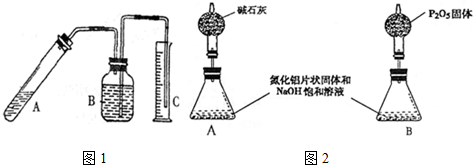
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
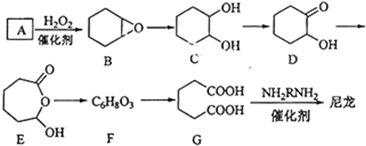
 +H2O→
+H2O→ (不需注明条件,其他无机试剂任选).
(不需注明条件,其他无机试剂任选). .
.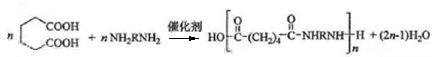 .
.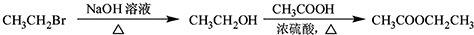
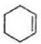 $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$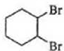 $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$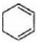 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原电池的总反应为Fe+Cu2+═Fe2++Cu | |
| B. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-═H2↑ | |
| D. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 为了防止电池中的重金属等污染土壤和水体,应积极开发废电池回收利用技术 | |
| C. | 工业上采用电解熔融氯化铝制取金属铝 | |
| D. | 金属的腐蚀分为化学腐蚀和电化学腐蚀,但二者的本质相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com