
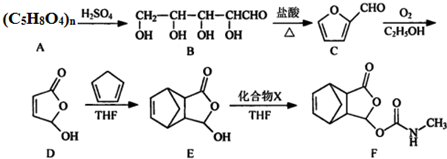
 .
. .
.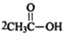 $\stackrel{P_{2}O_{3}}{→}$
$\stackrel{P_{2}O_{3}}{→}$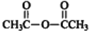 ,化合物
,化合物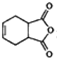 是合成抗病毒药阿普洛韦的中间体,请设计合理方案以
是合成抗病毒药阿普洛韦的中间体,请设计合理方案以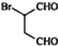 和
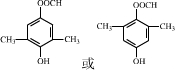
和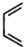 为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
分析 (1)根据D的结构简式可知,化合物D中含氧官能团为酯基和羟基;根据E的结构简式可知E的分子式;根据手性碳原子的定义分析;
(2)C中含有醛基,可与氢氧化铜浊液在加热条件下发生氧化还原反应生成羧基;
(3)能发生银镜反应和水解反应,说明含有醛基和酯基,可为甲酸酯,能与FeCl3溶液发生显色反应,说明含有酚羟基;
(4)根据EF的结构简式并根据原子守恒判断X;
(5)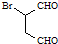 可发生催化氧化生成
可发生催化氧化生成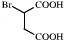 ,然后发生消去反应生成
,然后发生消去反应生成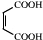 ,然后发生取代反应生成
,然后发生取代反应生成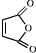 ,进而与
,进而与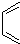 作用可生成目标物.
作用可生成目标物.
解答 解:(1)根据D的结构简式可知,化合物D中含氧官能团的名称为酯基、羟基,根据E的结构简式可知E的分子式为C9H10O3,根据B物质的结构简式可知,分子中含有3个手性碳原子,即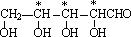 ,
,
故答案为:酯基、羟基;C9H10O3;3;
(2)C中含有醛基,能和新制的氢氧化铜悬浊液反应,则C与新制氢氧化铜反应的化学方程式为 ,
,
故答案为: ;
;
(3)能发生银镜反应和水解反应,这说明分子中含有酯基和醛基.能与FeCl3溶液发生显色反应,说明分子中含有酚羟基.又因为核磁共振氢谱有4个峰,所以应该是甲酸形成的酯,则可能的结构简式有 ,
,
故答案为: ;
;
(4)根据EF的结构简式并根据原子守恒可知,该反应应该是加成反应,所以X的结构简式应该是CH3N=C=O,故答案为:CH3N=C=O;
(5) 可发生催化氧化生成
可发生催化氧化生成 ,然后发生消去反应生成
,然后发生消去反应生成 ,然后发生取代反应生成
,然后发生取代反应生成 ,进而与
,进而与 作用可生成目标物,反应流程为
作用可生成目标物,反应流程为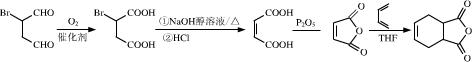 ,
,
故答案为: .
.
点评 本题考查有机合成,是高考中的常见题型,属于中等难度的试题,涉及有机物手性碳原子、官能团、结构简式、同分异构体、方程式以及有机合成路线的设计等,试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练.


科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7 | |
| B. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量的氯气通入碘化亚铁溶液:3Cl2+2Fe2++4I-═6Cl-+2Fe3++2I2 | |
| B. | 硫酸在加热条件下将铜氧化:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 在氢氧化钡溶液中加入过量的硫酸氢铵:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3↑+2H2O | |
| D. | 将金属钠投入水中:2Na+2H+═2Na++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定性检验C2H5Cl中的氯元素:将C2H5Cl和NaOH溶液混合加热后,再加AgNO3溶液 | |
| B. | 检验汽油是否含有烯烃:取少量汽油,加入碘酒,振荡并观察 | |
| C. | 制乙烯:将无水乙醇加热到170℃ | |
| D. | 蛋白质变性实验:将硫酸铜溶液滴入鸡蛋清溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;Na2O2的电子式
;Na2O2的电子式 .
.| 非金属性 | 离子半径 | 热稳定性 | 酸性 |
| N<Cl | S2->Na+ | NH3<H2O | H2SO4 >HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com