
【题目】常温下,向20ml某浓度的硫酸溶液中滴入0.1mol.l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是

A.V=40
B.C点所示溶液中:c(H+)-c(OH-)=2c(NH3.H2O)
C.d点所示溶液中:c(NH4+)=2c(SO42-)
D.NH3.H2O的电离常数K=10-4
【答案】C
【解析】
试题分析:A、a点溶液是硫酸,根据由水电离出的氢离子浓度可知溶液中c(OH-)=10-13 mol/L ,则溶液中c(H+)=0.1mol/L ,c(H2SO4) =0.05 mol/L 。随着氨水的滴入,溶液酸性减弱,对水的电离的抑制减弱,水电离出的c(H+) 增大,当由水电离出的c(H+) 达到最大值时,就是(NH4)2SO4 的量最多时,也就是酸碱滴定的终点,所以c 点就是酸碱恰好反应的点,所以V=20ml,A错误;B、c 点就是酸碱恰好反应的点,溶液中的溶质是(NH4)2SO4 ,根据电荷守恒c(H+) +c(NH4+)= 2c(SO42-)+ c(OH-),物料守恒c(NH3.H2O) +c(NH4+)= 2c(SO42-),所以c(H+)-c(OH-)=c(NH3.H2O),B错误;C、c点往后,氨水开始过量,氨水对水的电离又起抑制作用,由水电离出的c(H+) 又开始下降。到d 点时,溶液中由水电离出的氢离子浓度与纯水中由水电离出的氢离子浓度相等,此时溶液中(NH4)2SO4 的水解和NH3.H2O 的电离互相抑制,使溶液显中性,根据电荷守恒得c(NH4+)=2c(SO42-),C正确;D、c 点时溶液中的溶质是(NH4)2SO4 ,只发生NH4+的水解,由图中数据可知NH4+的水解常数Kh= c(NH3.H2O) c(H+)/ c(NH4+)=(5×10-6)2/0.1=2.5×10-10,NH3.H2O的电离常数K= c(NH4+) c(OH-)/ c(NH3.H2O),K×Kh=Kw=10-14,则K=0.4×10-4,D错误。答案选C。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol·L-1 NH4Cl溶液②0.1 mol·L-1 CH3COONH4溶液 ③0.1 mol·L-1 NH4HSO4溶液 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液 ⑤0.1 mol·L-1氨水
请根据要求填写下列空白:
(1)溶液①呈______(填“酸”、“碱”或“中”)性,其原因是________________(用离子方程式表示)。
(2)溶液②③中c(NH![]() )的大小关系是②___(填“>”、“<”或“=”)③。
)的大小关系是②___(填“>”、“<”或“=”)③。
(3)在溶液④中________(离子)的浓度为0.1 mol/L;NH3·H2O和________(离子)的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”,下同)NH![]() 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH![]() 浓度的大小关系是c(CH3COO-)________c(NH
浓度的大小关系是c(CH3COO-)________c(NH![]() )。
)。
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:______________________________。
②若溶液M由10 mL 2 mol·L-1 NaHA溶液与10 mL 2 mol·L-1 NaOH溶液混合而得,则溶液M的pH________(填“>”、“<”或“=”)7。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 锌粉加入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B. 氯化铁溶液腐蚀铜线路板:2Fe3++3Cu=2Fe+3Cu2+
C. 氢氧化铝加入醋酸溶液中:Al(OH)3+3H+=Al3++3H2O
D. 氯化钡溶液滴入硫酸氢钠溶液中:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为O2+2H2O+4e-===4OH-
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.1%),还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:
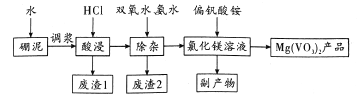
回答下列问题:
(l)Mg(VO3)2 中V的化合价为_____,副产物的电子式为_______。
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为______。写出”酸浸”后溶液中存在的金属阳离子_______,废渣1可用于制作_______,该物质在信息传输中具有重要应用。
(3)“除杂”过程加人双氧水的目的是_______(用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于l×10-6mol·L-1,在室温下需调节pH范围为__________[已知Ksp[Fe(OH)3]= 1×10-39, Ksp[Al(OH)]=1×10-33, pH=9.3时,Mg2+开始沉淀]。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:__________。
(5)偏钒酸氨可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式_________。
(6)现用a t硼泥生产Mg(VO3)2,若生产过程的产率为6%,则能生产出Mg(VO3)2产品的
质量为_________t (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是分属三个短周期六种主族元素,且原子序数依次增大。①B是植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染。②C和D能形成电子总数为30和38的两种化合物。③E的某种氧化物M可用做漂白剂。请回答下列问题:
(1)元素F在元素周期表中的位置是______________________________。
(2) C、D、E 三种元素原子半径由小到大的顺序是__________________(用元素符号回答); C、D、E 三种元素形成的简单离子的离子半径由小到大的顺序是__________________ (用离子符号回答)。
(3) C和D形成电子总数为38的化合物中化学键类型有__________________________(填“离子键”、“极性共价键”、“非极性共价键”)。
(4)写出D的最高价氧化物水化物的电子式______________________。
(5) E、F两种元素形成氢化物中还原性较强的是_________________(填化学式); 用电子式表示该化合物的形成过程________________________________________。
(6)C、D、F形成的某种化合物N也可用做漂白剂,M、N以物质的量1∶1混合,混合物没有漂白性。用离子方程式解释其原因_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )

A. 两烧杯中溶液的pH均增大
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中铜片表面均无气泡产生
D. 产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
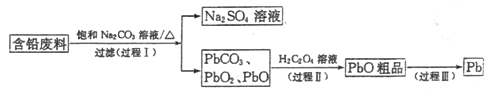
(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见如图。
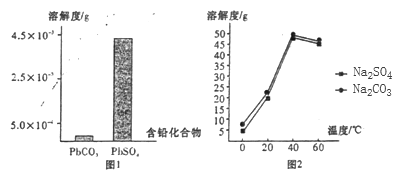
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据如图,解释可能原因:
i.温度降低,反应速率降低; ii.______________(请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是___________。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式__________。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图。
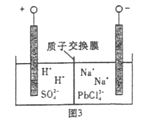
①阴极的电极反应式是____________。
②电解一段时间后,PbCl42-浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为________ mol·L-1。(假设电解前后硫酸溶液的体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com