
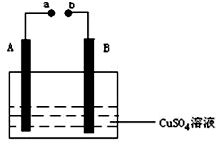
 如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:分析 (1)B电极质量增加依据电解池原理分析判断,B为电解池的阴极,A为阳极,a为电源正极,b为电源负极;
(2)电解过程中阳极水电离的氢氧根离子失去电子生成氧气,阴极电极反应为Cu2++2e-=Cu,据此写出电极总反应方程式.
解答 解:B电极质量增加依据电解池原理分析判断,B为电解池的阴极,A为阳极,a为电源正极,b为电源负极;电解过程中阳极电极反应4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,
(1)根据分析可知,a电极是电源的正极,b为电源负极,
故答案为:负;
(2)依据分析可知A为阳极,溶液中水电离的氢氧根离子失电子生成氧气,B为阴极,溶液中铜离子得到电子生成铜,电极反应为Cu2++2e-=Cu,则电极总反应方程式为:2Cu2++2H2O=2Cu+O2+4H+,
故答案为:2Cu2++2H2O=2Cu+O2+4H+.
点评 本题考查了电解池原理及其应用,题目难度不大,明确电极判断和电极反应的书写方法是解题关键,注意熟练掌握电解池工作原理,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入四氯化碳,操作振荡、静置, 现象CCl4层呈橙红色,水层呈无色 | 假设1正确 |
| ②向溶液中另入KSCN溶液, 现象溶液变为红色 | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
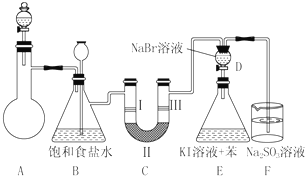
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用敞开放置久了的浓硫酸进行配制 | B. | 量取浓硫酸仰视刻度线 | ||
| C. | 配制过程中未洗涤烧杯和玻璃棒 | D. | 配制前,容量瓶有少许蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青石棉是一种易燃品且易溶于水 | |
| B. | 青石棉的化学组成用氧化物的形式可表示为:Na2O•FeO•2Fe2O3•8SiO2•H2O | |
| C. | 1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6 L 3 mol•L-1 HNO3溶液 | |
| D. | 1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5 L 2 mol•L-1HF溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
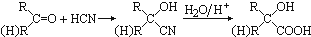 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成: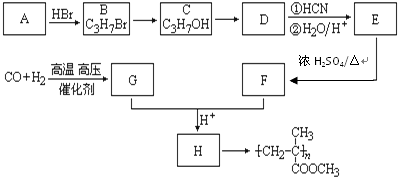
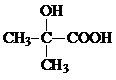 ;
; ;
;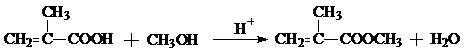 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com