
课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
如图是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的是证明CO具有还原性的实验装置。
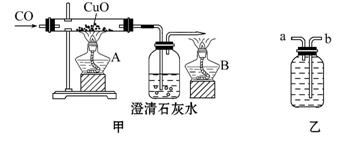
(1)实验时应先点燃 (填“A”或“B”)处的酒精灯。
(2)硬质试管中反应的化学方程式为 。
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如图是他设计的贮气瓶,尾气应从 (选“a”或“b”)口通入(其他装置略)。
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为丙的设计是否有必要 ,理由是 。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的? 。
科目:高中化学 来源: 题型:
下列说法中,正确的是
A .反应产物的总能量大于反应物的总能量时,△H< 0
.反应产物的总能量大于反应物的总能量时,△H< 0
B.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进 行的方向
行的方向
C.ΔH<0、ΔS>0的反应在温度低时不能自发进行
D.一个化学反应的△H仅与反应的起始状 态和反应的最终状态有关,与反应
态和反应的最终状态有关,与反应
途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:NH2COO-+2H2O  HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图
HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图
所示。以下分析正确的是
A.无法判断T1和T2的大小关系
B.T1 ℃时,第6min反应物转化率为6.25%
C.T2 ℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1
D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。
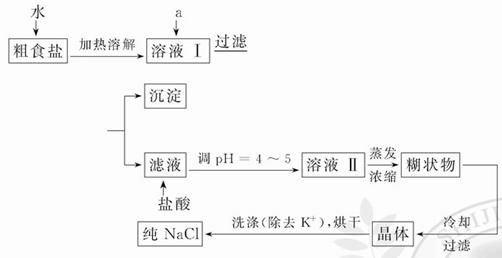
(1)粗食盐常含有少量K+、Ca2+、Mg2+、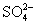 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳 冷水
①欲除去溶液Ⅰ中的Ca2+、Mg2+、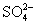 离子,选出a所代表的试剂,按滴加顺序依次为_________________________________________________(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为_________________________________________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 ____。
③在整个实验过程中,下列实验装置不可能用到的是 _ (填序号)。

(2)电解饱和食盐水的装置如图所示:
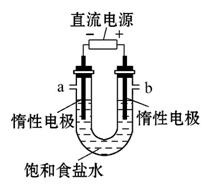
若收集的H2为2 L,则同样条件下收集的Cl2 (填“>”“<”或“=”)2 L,原因是(用化学方程式解释) __________________________。
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为 。装置b端口出来气体的检验方法是________________
________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下进行性质比较的实验设计,不合理的是( )
A.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4 mol·L-1NaOH溶液中
B.比较氯、溴非金属性:氯气通入溴化钠溶液中
C.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中
D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
高温及催化剂作用下,某反应的平衡常数K=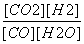 。恒容时,温度升高,H2浓度减小,下列说法正确的是( )
。恒容时,温度升高,H2浓度减小,下列说法正确的是( )
A.恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的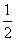
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,正反应速率减小,逆反应速率增大
D.该反应化学方程式为CO2+H2 CO+H2O ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196 kJ·mol-1。
2SO3(g) ΔH=-196 kJ·mol-1。
(1)该反应的平衡常数表达式为K=________________;某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)________v(逆)(填“<”“>”或“=”)
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以如图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极反应式________________________________________________________________________。
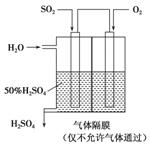
(5)为稳定持续生产,硫酸的浓度应维持不变,则通入SO2和水的质量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:
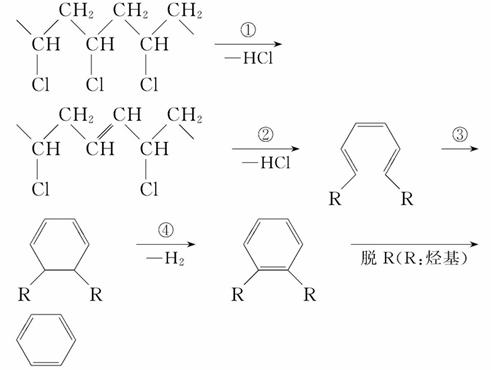
关于聚氯乙烯制品失火导致的火灾的说法正确的是( )
A.火灾中由聚氯乙烯产生的有害气体主要是HCl、CO、C6H6等
B.在火灾现场可用湿毛巾捂住口鼻并迅速跑往高处呼吸新鲜空气
C.反应①、④所属反应类型分别是取代反应、氧化反应
D.聚氯乙烯能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题:
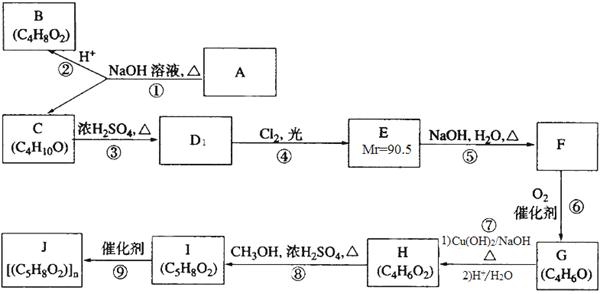
(1)④的反应类型是__________________,⑧的反应类型是__________________;
(2)B为有支链的有机化合物,B 的结构简式为______________________;C在浓硫酸作用下加热反应能生成三种烯烃:其中一种(D1)为“反—2—丁烯”;则另外两种(D2、D3)的结构简式分别为______________________、_____________________;
(3)A的分子式为:______________;J的结构简式为_____________________;
(4)写出下列反应的化学方程式:
反应⑤:_____________________________________________________;
反应⑦的第一步:_____________________________________________________;
(5)与H具有相同官能团的H的同分异构体的结构简式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com