
| A. | 1L 0.1mol/L醋酸 | B. | 0.5L 0.1mol/L H2SO4溶液 | ||
| C. | 1L 0.1mol/L盐酸 | D. | 2L 0.1mol/L H2SO3溶液 |
科目:高中化学 来源: 题型:选择题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| A. | 反应在前四小时的平均速率为v(A)═0.0122mol•L-1•h-1 | |
| B. | 他条件不变,升温,正逆反应速率都增大 | |
| C. | 该反应到达平衡时A的转化率为94.1% | |
| D. | 将容积的体积缩小到原来的一半,达平衡后C的百分含量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 将铁屑加入Fe3+溶液中:Fe3++Fe═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液保存在带玻璃塞的试剂瓶中 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 浓硝酸保存在棕色细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
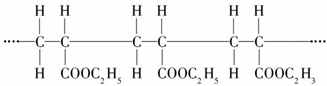
| A. | 其单体是CH2=CH2和HCOOC2H5 | B. | 这是缩聚反应产物 | ||
| C. | 其链节是CH3CH2-COOC2H5 | D. | 其单体是CH2=CH-COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5×10-7 mol•L-1 | B. | 1.0×10-7 mol•L-1 | ||
| C. | $\frac{1×1{0}^{-14}}{2.5×1{0}^{-7}}$mol•L-1 | D. | 无法确定c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al203、HCl、NaOH | B. | NH3、O2、HNO3 | ||
| C. | SiO2、NaOH、HF | D. | CO2、Ca(OH)2、Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com