
科目:高中化学 来源: 题型:解答题
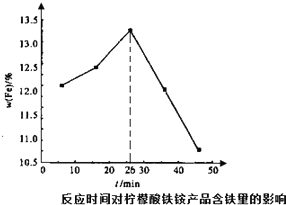 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下: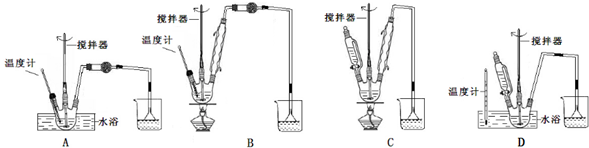
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1LC2H5OH燃烧后生成的CO2分子数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 电解食盐水水时,当产生22.4LH2时,电路中转移的电子数为2NA | |
| C. | 标准状况下,11.2LCH4和C2H4混合气体中含有碳原子的数目为2NA | |
| D. | NH3易溶于水,3.4gNH3溶于1LH2O,溶液中氮原子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
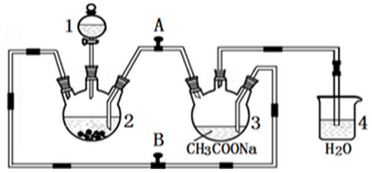
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
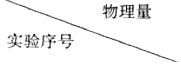 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com