
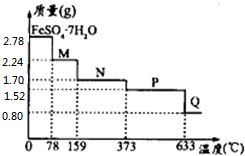
分析 将2.78gFeSO4•7H2O物质的量=$\frac{2.78g}{278g/mol}$=0.01mol,样品隔绝空气加热脱水,若全部失去结晶水得到固体硫酸亚铁质量=0.01mol×152g/mol=1.52g,失去结晶水的质量=0.01mol×7×18g/mol=1.26g,
①图象分析可知M点固体质量为2.24g,失去结晶水质量=2.78g-2.24g=0.54g,物质的量为$\frac{0.54g}{18g/mol}$=0.03mol,据此写出100°C的化学式;
②将2.78gFeSO4•7H2O物质的量=$\frac{2.78g}{278g/mol}$=0.01mol,加热变化为FeSO4•H2O,失去结晶水0.06mol,剩余固体质量=2.78g-0.06mol×18g/mol=1.7g,图象中对比得到所存在的最高温度;
③380℃的P时固体质量为1.52g,说明全部失去结晶水,633°C硫酸亚铁分解,得到固体0.8g,其中n(Fe)=n( FeS04•7H20)=0.01mol,m(Fe)=0.01mol×56g/mol=0.56g,则固体中m(O)=0.80g-0.56g=0.24g,n(O)=$\frac{0.24g}{16g/mol}$=0.015mol,则n(Fe):n(O)=0.01mol:0.015mol=2:3,则固体物质Q的化学式为Fe2O3,依据氧化还原反应电子守恒计算得到反应分解产物,以此解答该题
解答 解:将2.78gFeSO4•7H2O物质的量=$\frac{2.78g}{278g/mol}$=0.01mol,样品隔绝空气加热脱水,若全部失去结晶水得到固体硫酸亚铁质量=0.01mol×152g/mol=1.52g,失去结晶水的质量=0.01mol×7×18g/mol=1.26g,
①图象分析可知M点固体质量为2.24g,失去结晶水质量=2.78g-2.24g=0.54g,物质的量为$\frac{0.54g}{18g/mol}$=0.03mol,剩余结晶水0.04mol,据此写出100°C的化学式为:FeSO4•4H2O,
故答案为:FeSO4•4H2O;
②将2.78gFeSO4•7H2O物质的量=$\frac{2.78g}{278g/mol}$=0.01mol,加热变化为FeSO4•H2O,失去结晶水0.06mol,剩余固体质量=2.78g-0.06mol×18g/mol=1.7g,图象中对比得到,所存在的最低温度为159°C,所存在的最高温度为373°C,
故答案为:373;
③380℃的P时固体质量为1.52g,说明全部失去结晶水,633°C硫酸亚铁分解,得到固体0.8g,其中n(Fe)=n( FeS04•7H20)=0.01mol,m(Fe)=0.01mol×56g/mol=0.56g,则固体中m(O)=0.80g-0.56g=0.24g,n(O)=$\frac{0.24g}{16g/mol}$=0.015mol,则n(Fe):n(O)=0.01mol:0.015mol=2:3,则固体物质Q的化学式为Fe2O3,由计算知铁的化合价升高,必有硫的化合价降低,即有二氧化硫生成,设SO2、SO3的物质的量分别为x、y,则
x+y=0.01
64x+80y=1.52g-0.80g
解得x=0.005mol
y=0.005mol,
所以方程式为:2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,
加热至650℃时反应的气体产物通入BaCl2溶液中,生成的沉淀的化学式为BaSO4,溢出气体为SO2,若通入Ba(NO3)2稀溶液中.其中二氧化硫具有还原性,在酸性溶液中硝酸根离子氧化二氧化硫为硫酸,硝酸钡还原生成一氧化氮,则逸出的气体为NO,
故答案为:BaSO4,SO2,NO.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握物质的质量的变化关系,能读懂图象,从质量守恒的角度解答该题,难度较大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )| A. | 6:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的氢化物的水溶液呈酸性 | B. | M2在常温常压下一定是气体 | ||
| C. | MO3-中的M元素只能被还原 | D. | M位于元素周期表的第VA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
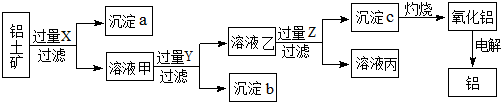
| A. | 实验室中灼烧操作通常在坩埚中进行 | |
| B. | 若X为烧碱,则Z为氨气,沉淀a为红棕色,可作颜料 | |
| C. | 若X为盐酸,则Z为CO2,溶液丙只含NaCl和Na2CO3 | |
| D. | 上述过程中所发生的反应有分解反应、复分解反应、氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应①和②中,氯化钠均既是氧化剂,又是还原剂 | |
| B. | 在反应①中氯气是还原产物,在反应②中氢气是还原产物 | |
| C. | 若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等 | |
| D. | 若消耗等质量的氯化钠,则反应①和②中转移电子总数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/LpH=2的HF溶液加水稀释,$\frac{c({H}^{+})}{c(HF)}$增大 | |
| B. | 向0.2 mol/L NaHCO3溶液中加入等体积0.1 mol/L NaOH溶液c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 向0.1mol/L NaHSO3溶液中通入NH3至中性(溶液体积视为不变),则 c(NH4+)+c(H2SO3)═c(SO32-) | |
| D. | 现有常温下水电离出的c(H+)均为1×10-11 mol/L且体积相同的三种溶液:①HCl溶液②CH3COOH溶液③NaOH溶液,分别与足量铝粉反应,生成氢气的量③最少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com