

分析 (1)根据混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2;
(2)根据浓硫酸可作干燥剂;根据SO2能与碱石灰反应,而氧气与与碱石灰不反应;
(3)根据氧气不溶于水,可用排水法测定气体的体积;
(4)根据量筒内液体的体积即为O2的体积,根据n=$\frac{v}{vm}$来分析;根据干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的),再根据电子得失守恒n(O2)×4=n(SO2)×2求出分解产生的SO2的物质的量,最后根据方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑求出SO3的物质的量;
(5)依据(4)计算得到生成物的物质的量,然后写出化学方程式.
解答 解:(1)混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2:SO3+2NaHSO3=Na2SO4+H2O+2SO2↑,可NaHSO3来除去三氧化硫,
故答案为:吸收生成的SO3气体;SO3+2NaHSO3=Na2SO4+H2O+2SO2↑;
(2)浓硫酸可作干燥剂,可吸收SO2和O2中的水蒸气,
故答案为:干燥SO2和O2;
(3)因氧气不溶于水,可用排水法测定气体的体积,将由D来的气体将E中的水压到量筒F中,测定生成O2的体积,
故答案为:由D来的气体将E中的水压到量筒F中,测定生成O2的体积;
(4)量筒内液体的体积即为O2的体积,其物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,根据电子得失守恒n(O2)×4=n(SO2)×2,即0.005mol×4=n(SO2)×2,则n(SO2)=0.01mol,干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的)为1.28g,物质的量为0.02mol,所以与NaHSO3反应生成的SO2为0.01mol,由方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑可知SO3的物质的量为0.005mol,
故答案为:0.01;0.005.
(5)依据(4)计算得到生成物的物质的量写出化学方程式为3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑,
故答案为:3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑.
点评 本题主要考查了实验的原理与计算,在计算时要抓住电子得失守恒,尤其要注意干燥管增重的质量为SO2的质量包括原来的和通NaHSO3后生成的,题目难度中等.


科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8N4 | B. | C6H12N4 | C. | C6H10N4 | D. | C4H10N4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
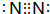 ,e的氢化物的结构式为
,e的氢化物的结构式为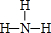 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气是一种清洁的化石燃料 | |
| B. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 | |
| C. | 煤是由有机物和无机物组成的复杂的混合物 | |
| D. | 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠固体与水反应:2O22-+2H2O═OH-+O2↑ | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 稀硝酸与过量的铁屑反应Fe+4H-+NO3-═Fe3++NO↑+2H2O | |
| D. | NaAlO2溶液中通入过量二氧化碳AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池放电时,正极和负极的电极质量均增大 | |
| B. | 反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H<0 | |
| C. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 | |
| D. | C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com