

分析 硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质,硅孔雀石矿粉加入稀硫酸溶解,加入过氧化氢氧化亚铁离子浸取后过滤,得到滤渣A主要为SiO2、H2SiO3,滤液A含有Cu2+、Fe3+、Al3+、H+,加入铜的化合物调节溶液PH=4使铁离子全部沉淀,这样能不引入新杂质此时铝离子有部分沉淀,过滤得到滤液B主要是硫酸铜溶液,含有少量硫酸铝和硫酸溶液,通过蒸发浓缩蒸发,冷却结晶得到硫酸铜晶体,母液中加入铁粉,过滤可得铜,滤液中硫酸亚铁等,加入消石灰沉淀后排放,据此答题.
解答 解:硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质,硅孔雀石矿粉加入稀硫酸溶解,加入过氧化氢氧化亚铁离子浸取后过滤,得到滤渣A主要为SiO2、H2SiO3,滤液A含有Cu2+、Fe3+、Al3+、H+,加入铜的化合物调节溶液PH=4使铁离子全部沉淀,这样能不引入新杂质此时铝离子有部分沉淀,过滤得到滤液B主要是硫酸铜溶液,含有少量硫酸铝和硫酸溶液,通过蒸发浓缩蒸发,冷却结晶得到硫酸铜晶体,母液中加入铁粉,过滤可得铜,滤液中硫酸亚铁等,加入消石灰沉淀后排放,
(1)根据上面的分析可知,A成份中除SiO2外还有H2SiO3,故答案为:H2SiO3;
(2)加入过氧化氢氧化亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)根据上面的分析可知,调节溶液pH的同时不能引入新的杂质,所以可选用的最佳试剂是氧化铜,故选C;
(4)溶液pH约为4时,溶液中氢氧根离子的浓度为10-10mol/L,此时c(Al3+)•c3(OH-)=1×10-2×(10-10)3 =1×10-32>3.2×10-34,所以有氢氧化铝沉淀出现,
故答案为:有;
(5)根据电解原理,与电源负极相连的阴极上是溶液中的不活泼的金属离子得电子析出单质,所以要回收铜,则铜在阴极析出,为保持乙方案中电流恒定,即溶液中离子所带电荷的浓度不变,B极即阳极应该使用铁做电极,由于电解过程中要消耗电能,所以该方法和甲相比较,最大的缺点是耗能,
故答案为:A;铁;耗能.
点评 本题借助硅孔雀石为原料制取硫酸铜的工艺流程,考查了铜及其化合物性质分析判断,化学方程式计算应用,沉淀溶解原理的应用,掌握基础是关键,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个。则这三种元素所组成的化合物的分子式不可能是
A.X2YZ4 A. XYZ3 B. X3YZ4 C. X4Y2Z7
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
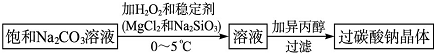
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 加入试剂 | 离子方程式 |
| (1) | 稀HCl | CO32-+2H+=CO2↑+H2O |
| (2) | BaCl2溶液 | Ba2++SO42-=BaSO4↓ |
| (3) | AgNO3溶液 | Ag++Cl-=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是中学实验中常用到的仪器.
如图是中学实验中常用到的仪器.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com