
【题目】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
I.直接作燃料
己知:C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为____________________________________________________________________________ 。
II.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
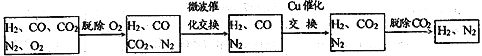
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:CO2+CH4![]() CO+H2 CO+H2O
CO+H2 CO+H2O![]() CO2+ H2
CO2+ H2
(2)气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因:____________________________________________________________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)= ______________。
III.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2molNO 和0.1molCl2,发生如下反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5
2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5![]() 10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率为α2,则α1 ____α2 (填“>”、“<”或“=”);平衡常数K____ (填增大”“减小 ”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为_____________________________。
【答案】 CO(g)+1/2O2(g)=CO2(g) ΔH=-283kJ/mol 该反应是吸热且熵增的反应,只有在较高温度下ΔG=ΔH-TΔS 才有可能小于0,反应才有利于自发进行 88.36∶55(或1.61∶1或8∶5) 0.025 < 不变 HC1O+2C1O2-+H+=2ClO2↑+Cl-+H2O
【解析】(1)①C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol,②2C(s)+O2(g)=2CO(g) △H=-221kJ/mol,根据盖斯定律,将(①×2-②)×![]() 得:CO(g)+ O2(g)=CO2(g)ΔH=[(-393.5kJ/mol)×2-(-221kJ/mol)]×
得:CO(g)+ O2(g)=CO2(g)ΔH=[(-393.5kJ/mol)×2-(-221kJ/mol)]×![]() =-283kJ/mol,故答案为:CO(g)+1/2O2(g)=CO2(g)ΔH=-283kJ/mol;
=-283kJ/mol,故答案为:CO(g)+1/2O2(g)=CO2(g)ΔH=-283kJ/mol;
(2)该反应是吸热反应,且属于熵增的反应,只有在较高温度下ΔG=ΔH-TΔS才有可能小于0,反应才有利于自发进行,因此气体通过微波催化交换炉需要较高温度,故答案为:该反应是吸热且熵增的反应,只有在较高温度下ΔG=ΔH-TΔS才有可能小于0,反应才有利于自发进行;
(3)含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64%,则H2约为1-55%-25%-15%-1.64%=3.36%,假设气体总量为100mol,经过脱氧后含有55mol N2,25molCO、15molCO2、3.36molH2,经过CO2+CH4![]() 2CO+2H2,反应后气体中含有55mol N2,(25+15×2)molCO、(15×2+3.36)molH2,再经过CO+H2O
2CO+2H2,反应后气体中含有55mol N2,(25+15×2)molCO、(15×2+3.36)molH2,再经过CO+H2O![]() CO2+ H2反应后,气体中含有55mol N2,(25+15×2)molCO2、(25+15×2+15×2+3.36)molH2,因此V(H2):V(N2)= n(H2):n(N2)= (25+15×2+15×2+3.36)mol:55mol= 88.36∶55,故答案为:88.36∶55;
CO2+ H2反应后,气体中含有55mol N2,(25+15×2)molCO2、(25+15×2+15×2+3.36)molH2,因此V(H2):V(N2)= n(H2):n(N2)= (25+15×2+15×2+3.36)mol:55mol= 88.36∶55,故答案为:88.36∶55;
(4)10min内v (ClNO)=7.5![]() 10-3mol/(L·min),则平衡是c (ClNO)=7.5
10-3mol/(L·min),则平衡是c (ClNO)=7.5![]() 10-3mol/(L·min)×10min =0.075 mol/L,n (ClNO)= 0.075 mol/L×2L=0.15mol,根据2NO(g)+Cl2(g)
10-3mol/(L·min)×10min =0.075 mol/L,n (ClNO)= 0.075 mol/L×2L=0.15mol,根据2NO(g)+Cl2(g) ![]() 2ClNO(g),反应的氯气为0.075mol,则平衡后n(Cl2)= 0.1mol-0.075mol=0.025mol,由于该反应为气体体积减小的反应,若反应在恒压条件下进行,相当于平衡时增大压强,平衡正向移动,NO的转化率增大,即α1<α2;温度不变,平衡常数K不变,故答案为:0.025;<;不变;
2ClNO(g),反应的氯气为0.075mol,则平衡后n(Cl2)= 0.1mol-0.075mol=0.025mol,由于该反应为气体体积减小的反应,若反应在恒压条件下进行,相当于平衡时增大压强,平衡正向移动,NO的转化率增大,即α1<α2;温度不变,平衡常数K不变,故答案为:0.025;<;不变;
(5)NCl3中Cl元素为+1价,NCl3发生水解产物之一具有强氧化性,为次氯酸,次氯酸能将稀盐酸中的NaClO2氧化成ClO2,反应的离子方程式为HC1O+2C1O2-+H+=2ClO2↑+Cl-+H2O,故答案为:HC1O+2C1O2-+H+=2ClO2↑+Cl-+H2O。


科目:高中化学 来源: 题型:
【题目】下列反应原理中,不符合工业冶炼金属实际情况的是
A.2HgO![]() 2Hg+O2↑ B.4Al+3MnO2
2Hg+O2↑ B.4Al+3MnO2![]() 2Al2O3+3Mn
2Al2O3+3Mn
C.2MgO![]() 2Mg+O2↑ D.4CO+Fe3O4
2Mg+O2↑ D.4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在炼锌厂和炼钢厂废弃的含锌烟道灰中,含有30%~50%的氧化锌,另含少量Fe2O3、CuO、SiO2、MnO等物质,可用该烟道灰为原料生产草酸锌晶体(ZnC2O4·2H2O)。
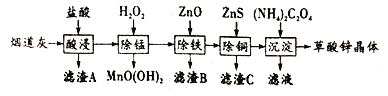
请回答下列问题:
(1)为了提高漫出速率,除将烟道灰处理得更细外,还可采取的措施有______ (写出一条)。
(2)证明除铁工序中Fe3+已经沉淀完全的实验步骤及现象是__________.
(3)上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是__________.
(4)己知: 常温下,Ksp[Fe(OH)3]=8.0×10-38.当加入ZnO控制反应液pH=5.0时,溶液中c(Fe3+)=_________.
(5)草酸能使酸性高锰酸钾溶液褪色,试写出相关反应的离子方程式:___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。
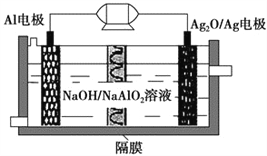
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.1 mol
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)支链有一个乙基且相对分子质量最小的烷烃的分子式为________
(2)分子中含有25个共价键且一氯代物只有一种的烷烃结构简式是________
(3)某饱和链状有机物分子中含有n个﹣CH3,b个﹣CH2﹣,m个![]() ,a个
,a个 ![]() ,其余为﹣Cl,则﹣Cl的数目是________
,其余为﹣Cl,则﹣Cl的数目是________
(4)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物CO2、H2O各1.2 mol,试回答:
①烃A的分子式是________。
②若烃A能使溴水褪色,在催化剂作用下与H2发生加成反应后生成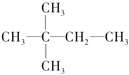 ,对A进行命名,其名称为________。
,对A进行命名,其名称为________。
③若烃A能使溴水褪色,且分子中所有碳原子共平面,则A的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题: I.将等物质的量的A、B混合放于2L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g).经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,v(C)=0.1mol/(Lmin).则:
(1)x= .
(2)前5min内B的反应速率v(B)= .
(3)平衡时A的转化率为 .
(4)II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)CO(g)+H2(g)△H. 已知:K(300℃)<K(350℃),则该反应是热反应.
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号. 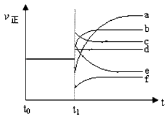
①缩小容器体积; ②降低温度
(6)已知反应①CO(g)+CuO(g)CO2(g)+Cu(s)②H2(g)+CuO(g)Cu(s)+H2O(g) 在相同的某温度下的平衡常数分别为K1和K2 , 该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=(用K1和K2表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量很少,但必不可少的微量元素有( )
A. Fe Mn Zn Mg
B. Zn Cu Mn Ca
C. H O Na Mg
D. Zn Cu B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)一瓶无色气体,可能含有 CH4和 CH2=CH2 或其中的一种,与一瓶 Cl2混合后 光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴. ①由上述实验现象推断出该瓶气体中一定含有 CH4 , 你认为是否正确,为什么? .
②上述实验可能涉及的反应类型有 .
(2)含有 ![]() 的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH﹣Cl 聚合而成的,其化学反应方程式是 .
的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH﹣Cl 聚合而成的,其化学反应方程式是 .
(3)实验室用加热无水乙醇与浓硫酸的混合物的方法制取乙烯,产物气体中常常混有二氧化 硫.利用下图装置和可选试剂验证产物气体中乙烯和二氧化硫均存在,图中①、②、③、④的容器内盛放的化学试剂分别是(填写代号)①②③④ 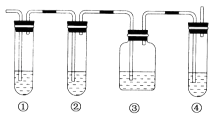
可选择的化学试剂有:A.品红溶液 B.浓烧碱溶液 C.浓硫酸 D.酸性高锰酸钾溶液 确认乙烯气体存在的现象是若将酸性高锰酸钾溶液换成溴 水,写出反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com