
| A. | 氯化钾溶液在电流作用下电离成K+和Cl- | |
| B. | 摩尔是表示物质所含微粒集体是多少的物理量 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 氧化还原反应的本质是有电子的转移 |
分析 A.电解质的电离不需要通电;
B.摩尔为物质的量的单位,不是物理量;
C.溶液、胶体与浊液的本质区别为分散质的直径大小;
D.存在电子转移是氧化还原反应实质.
解答 解:A.氯化钾溶液在水的作用下电离出K+和Cl-,与电流无关,故A错误;
B.物质的量是表示物质所含微粒集体是多少的物理量,而摩尔为物质的量的单位,故B错误;
C.溶液、胶体与浊液的本质区别为分散质的直径大小,只有胶体具有丁达尔现象,故C错误;
D.氧化还原反应的实质是电子的转移(得失或偏移),故D正确;
故选D.
点评 本题考查较为综合,涉及电离、分散系的分类依据、氧化还原反应、物质的量与摩尔的关系等知识,题目难度不大,注意掌握氧化还原反应的实质,明确分散系的类型及区别,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 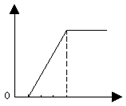 | B. | 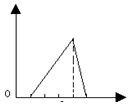 | C. | 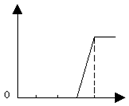 | D. | 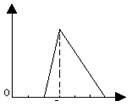 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: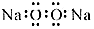 | B. | 次氯酸钠的结构式:H-Cl-OC | ||
| C. | 氯化铵的电子式: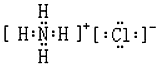 | D. | 硫离子的结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com