
分析 (1)①SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
②ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
③CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则根据盖斯定律可知①+②-③即得到反应;
(2)相同物质的量的SO2与NH3溶于水反应生成亚硫酸氢铵;结合溶液中电荷守恒和物料守恒分析判断选项;
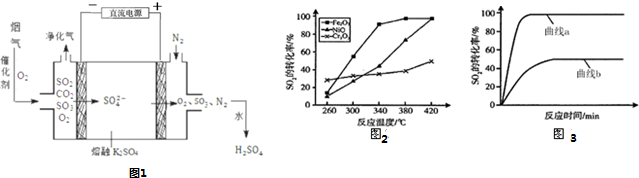
(3)①阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-;
②阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2;
③水的离子积常数KW=10-14,pH=9的Ba(OH)2溶液中氢氧根离子浓度为0.00001mol/L,pH=4的H2SO4溶液中氢离子浓度为0.0001mol/L,若所得混合液为中性,酸碱恰好完全反应,氢离子的物质的量等于氢氧根离子的物质的量,据此列式计算出Ba(OH)2 溶液与 H2SO4 溶液的体积比的值;依据Q=c(Ba2+)•c(SO42-)计算溶液中c(SO42-)≤1.0×10-5mol•L-1,则应保持溶液中 c(Ba2+)的值;
(4)Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源;
n(CO):n(SO2)越大,二氧化硫的转化率越大;
解答 解:(1)已知①SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
②ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
③CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则根据盖斯定律可知①+②-③即得到反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq)△H=△H1+△H2-△H3,
故答案为:△H1+△H2-△H3;
(2)相同物质的量的SO2与NH3溶于水发生反应生成碳酸氢铵,反应的离子方程式为SO2+NH3+H2O═NH4++HSO3-,溶液中存在电荷守恒:c(HSO3-)+2c(SO32-)+c(OH-)=c(H+)+c(NH4+),c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+),D正确,C错误;溶液中存在物料守恒:c(NH4+)+c(NH3•H2O)=c(HSO3-)+c(SO32-)+c(H2SO3),结合电荷守恒和物料守恒可知c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)=c(SO32-)+c(NH3.H2O)-c(H2SO3),所以A错误,B正确,
故答案为:BD;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2.
①氧气在阴极获得电子,故答案为:O2;
②阳极电极反应方程式为:2SO42--4e-=2SO3↑+O2↑,故答案为:2SO42--4e-=2SO3↑+O2↑;
③室温下,水的离子积常数KW=10-14,pH=9的Ba(OH)2溶液中氢氧根离子浓度为0.00001mol/L,pH=4的H2SO4溶液中氢离子浓度为0.0001mol/L,若所得混合液为中性,酸碱恰好完全反应,则有:n(H+)=n(OH-),设Ba(OH)2 溶液与 H2SO4 溶液的体积分别为aL、bL,即:0.00001mol/L×aL=0.0001mol/L×bL,a:b=10:1,Ba2+(aq)+SO42-(aq)?BaSO4(s),室温下,Ksp(BaSO4)=1.1×10-10,欲使溶液中c(SO42-)=2.0×10-4mol•L-1,Q=c(Ba2+)•c(SO42-)则应保持溶液中 c(Ba2+)≥$\frac{Ksp(BaS{O}_{4})}{2.0×1{0}^{-4}}$=$\frac{1.1×1{0}^{-10}}{2.0×1{0}^{-4}}$=5.5×10-7mol•L-1,
故答案为:10:1; 5.5×10-7;
(4)Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源,故选Fe2O3作催化剂,n(CO):n(SO2)越大,二氧化硫的转化率越大,故曲线a表示n(CO):n(SO2)=3:1的变化曲线,
故答案为:c;Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源;a;
点评 本题考查PH的简单计算、沉淀溶解平衡计算、盐类水解、原电池等,综合考查学生化学知识的应用能力和分析问题的能力,为高考常见题型,注意把握盐类水解和弱电解质的电离特点.注意若离子积Q大于>Ksp(BaSO4),则析出沉淀,反之,则无,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
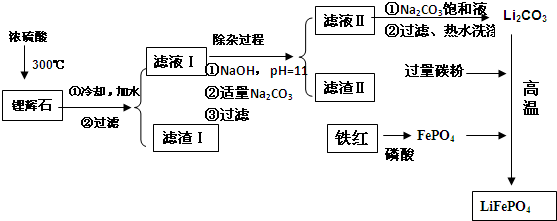
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,AC2的电子式
,AC2的电子式
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g钠在氧气中完全燃烧失去电子数为0.5NA | |
| B. | 1L 2 mol•L-1的AlCl3溶液中含Al3+数为2NA | |
| C. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| D. | 室温下,8g甲烷含有共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com