
 .
.| 离子半径 | 还原性 | 得电子能力 |
| N3-大于Al3+ | O2-小于S2- | 35Cl等于37Cl |
分析 (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键;
(2)质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;N的核电荷数=核外电子总数=7,最外层含有5个电子,据此画出其原子结构示意图;
(3)金属Na、Al、Ca为活泼金属,需要通过电解法冶炼;
(4)离子电子层相同时,核电荷数越大离子半径越小;元素非金属性越强,对应离子的还原性越弱;互为同位素的原子具有相同化学性质;
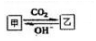
(5)图示中甲与乙在一定条件下能够相互转化,结合选项中离子性质分析;
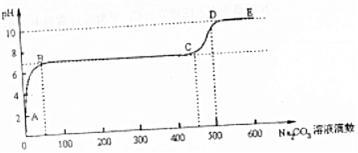
(6)由图象可知:BC段pH不变,说明发生反应CaCl2+Na2CO3=CaCO3↓+2NaCl;CD段碱性增强则为碳酸钠过量时,碳酸钠水解引起的,其水解主要以第一步为主.
解答 解:(1)H、C、N、O、Na、Al、A、Cl、Ca元素中形成的既含有离子键又含共价键的离子化合物的化学式有:NaOH、NaClO、Na2O2等;
既含极性共价键又含非极性共价键的共价化合物的化学式有:H2O2、C2H4、N2H4,
故答案为:NaOH(或NaClO、Na2O2等);H2O2(或C2H4、N2H4);
(2)O元素的一种中子数为10的核素的质量数为18,该原子可以表示为:818O,N的核电荷数、核外电子总数都是7,其原子结构示意图为: ,
,
故答案为:818O; ;
;
(3)上述9种元素中的金属有:Na、Al、Ca,它们都是活泼金属,工业上全部采用电解法冶炼,故A正确,
故答案为:A;
(4)N3-、Al3+都含有2个电子层,N3-的核电荷数较小,则离子半径较大,即离子半径:N3-大于Al3+;
非金属性O>S,则对应离子的还原性:O2- 小于S2-;
35Cl 与37Cl互为同位素,二者核外电子排布相同,则具有相同得电子能力,
故答案为:大于;小于;等于;
(5)甲与乙在溶液中的转化关系如右图所示: ,NH3、AlO2-、CO32- 能够满足图示转化关系,只有CH3COO-不与二氧化碳反应,无法从甲转化成乙,故D正确,
,NH3、AlO2-、CO32- 能够满足图示转化关系,只有CH3COO-不与二氧化碳反应,无法从甲转化成乙,故D正确,
故答案为:D;
(6)由图象可知BC段pH不变,则为发生反应CaCl2+Na2CO3=CaCO3↓+2NaCl,其离子方程式为:Ca2++CO32-=CaCO3↓;
CD段碱性增强则为碳酸钠过量时,碳酸钠水解引起的,其水解主要以第一步为主,其水解的离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:Ca2++CO32-=CaCO3↓;CO32-+H2O?HCO3-+OH-.
点评 本题考查较为综合,涉及化学键、极性键与非金属性、离子方程式书写、盐的水解原理、常见化学用语的表示方法等知识,题目难度中等,注意掌握常见化学用语 的书写原则,明确化学键类型及判断方法,试题知识点较多,充分考查了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
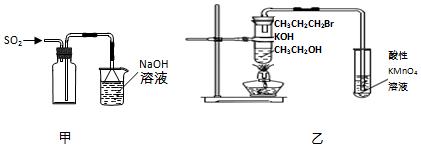
| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2+SO42-;氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 硝酸银与氯化氢溶液反应:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 碳酸氢钠溶液与稀硫酸溶液混合:HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]•3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4•2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
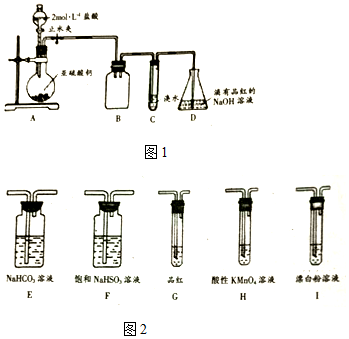
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

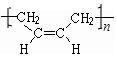 .
.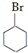 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$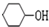 +NaBr.
+NaBr.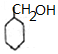 制备的合成路线.
制备的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol氧气与1mol二氧化硫的质量比约为2:1 | |
| B. | 2mol氧气与1mol二氧化硫的体积比约为1:1 | |
| C. | 1mol氧气与3mol二氧化硫的体积比约为1:3 | |
| D. | 1mol氧气与3mol二氧化硫的密度比约为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液,可制得金属镁 | |
| B. | 测定氢氧化钠是离子化合物时,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| C. | 向FeCl3溶液中加入Mg粉,可观察到有气泡产生 | |
| D. | 在某钠盐溶液中加入澄清石灰水,若有白色沉淀生成,则该钠盐一定是Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com