
| A. | 硅、二氧化硅、硅酸钠是工业上制造光导纤维的主要原料 | |
| B. | 甘油不是油,油脂不是酯 | |
| C. | 煤的液化、石油分馏都是物理变化 | |
| D. | 废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源 |
分析 A.光导纤维的主要原料为二氧化硅;太阳能电池的主要原料是硅;
B.甘油为丙三醇,油脂是甘油三酯;
C.石油的分馏是物理变化;煤液化是把固体炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术;
D.根据物质在回收后是否具有利用价值进行分析.
解答 解:A.光导纤维工业上制造光导纤维的主要原料,硅是制造太阳能电池的主要原料,故A错误;
B.甘油为丙三醇,所以甘油是醇,油脂是甘油三酯,所以油脂是酯,故B错误;
C.石油的分馏是物理变化;煤液化是把固体炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,有新物质生成,属于化学变化,故C错误;
D.纸类、塑料、金属、玻璃、等都是适宜回收循环使用和资源利用的废物,都属于可回收再利用的资源,故D正确.
故选ABC.
点评 本题主要考查了资源的回收、光导纤维,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,注意相关知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
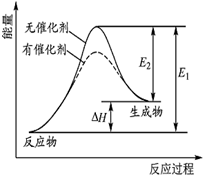 某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变 | |
| C. | 催化剂不能降低反应的活化能 | |
| D. | 逆反应的活化能小于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | W、X、Y三种元素最低价氢化物的稳定性依次降低 | |
| B. | X、Z、W的最高价氧化物对应的水化物酸性最强的是X | |
| C. | 五种元素均为非金属元素 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
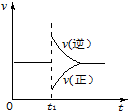 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )| A. | t1时改变某一条件,平衡将向逆反应方向移动 | |
| B. | 维持压强不变,t1时升高反应体系温度 | |
| C. | 维持温度不变,t1时扩大反应体系体积 | |
| D. | 维持温度、压强不变,t1时充入SO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 | |
| C. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
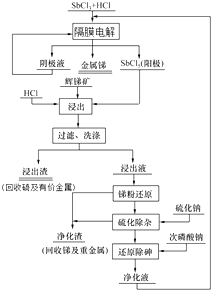
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
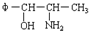 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com