
 X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.
X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.分析 X、Y、Z、Q、R为原子序数依次增大的前四周期元素.Q是所在周期中电负性最大的元素,处于ⅦA族,QZ2可替代Q2作新的自来水消毒剂,可推知Q为Cl;Z的L层有2个未成对电子,其核外电子排布式为1s22s22p2或1s22s22p4,X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面,该氢化物为C2H4,可推知X为C元素、Z为O元素;Y的原子序数介于碳、氧之间,故Y为N元素;R在周期表中位于d区,其基态原子有两个能级处于半充满状态,外围电子排布式为3d54s1,故R为Cr元素.
解答 解:X、Y、Z、Q、R为原子序数依次增大的前四周期元素.Q是所在周期中电负性最大的元素,处于ⅦA族,QZ2可替代Q2作新的自来水消毒剂,可推知Q为Cl;Z的L层有2个未成对电子,其核外电子排布式为1s22s22p2或1s22s22p4,X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面,该氢化物为C2H4,可推知X为C元素、Z为O元素;Y的原子序数介于碳、氧之间,故Y为N元素;R在周期表中位于d区,其基态原子有两个能级处于半充满状态,外围电子排布式为3d54s1,故R为Cr元素.
(1)Y为N元素,基态原子的电子排布式是1s22s22p3,
故答案为:1s22s22p3;
(2)X、Y、Z、Q形成的最简单气态氢化物中,常温下甲烷、氨气、HCl为气体,而水为液体,故沸点最高的是H2O,
故答案为:H2O;
(3)NO3-离子中N原子孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,空间结构为平面三角形,某离子是NO3-的等电子体,等电子体的结构相似,则该离子的立体构型是平面三角形,
故答案为:平面三角形;
(4)常温时,RZ2Q2易溶于二硫化碳,二硫化碳属于非极性分子,相似相溶,则RZ2Q2可能是非极性分子,
故答案为:非极性;
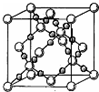
(5)由XZ2在高温高压下形成的晶胞图可知其使用原子晶体,SiO2晶体也属于原子晶体,由于C-O键长<Si-O键长,故C-O键更稳定,则与该晶体相比,SiO2晶体的熔点更低,
故答案为:低;
(6)CrO3在硫酸溶液中能与酒精发生反应生成Cr3+,乙醇被氧化,反应中氧化剂与还原剂的物质的量之比为2﹕3,根据电子转移守恒可知乙醇被氧化为乙醛,该反应的化学方程式是:2CrO3+3CH3CH2OH+3H2SO4=3CH3CHO+Cr2(SO4)3+6H2O,
故答案为:2CrO3+3CH3CH2OH+3H2SO4=3CH3CHO+Cr2(SO4)3+6H2O.
点评 本题是对物质结构与性质的考查,题目涉及核外电子排布、等电子体、分子结构与性质、晶体类型与性质、方程式的书写等,需要学生具备扎实的基础与灵活运用的能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
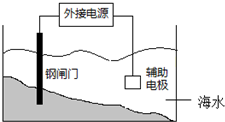
| A. | 钢闸门应与外接电源的负极相连 | |
| B. | 该装置的原理是“牺牲阳极阴极保护法” | |
| C. | 辅助电极材料可用锌 | |
| D. | 阴极的电极反应式:2Cl--2e→Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO3溶液中通入NH3至中性,溶液中存在:c(NH4+)>c(SO32-) | |
| B. | NH4Cl和NH3•H2O混合液pH=7,一定存在:c(NH4+)>c(Cl-) | |
| C. | NAHCO3溶液中存在HCO3-+H2O═H3O++CO32-,加水稀释后c(H+)减小 | |
| D. | pH相同的氯化铵与硫酸亚铁铵两种溶液中铵根离子浓度前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是氧化还原反应 | B. | 微粒的半径:r(Si)>r(Na) | ||
| C. | 硅酸的酸性强于碳酸 | D. | Na2CO3中含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:在加热时,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液 | |
| B. | 配制pH=3的CH3COOH溶液:取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL | |
| C. | 提纯含有少量溴的溴苯:向含有少量溴的溴苯中加入过量NaOH溶液充分振荡后,静置、分液,并除去有机相的水 | |
| D. | 比较AgCl、AgI的Ksp:向1 mL浓度均为2 mol•L-1的Cl-、I-的混合溶液中,加入1 mL 2 mol•L-1AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com