
分析 (1)利用盖斯定律①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)解答,从待求反应出发分析反应物、生成物在所给反应中的位置,通过相互加减可得;
(2)H2S热分解制氢为吸热反应,常向反应器中通入一定比例空气,使部分H2S燃烧可为H2S热分解反应提供热量;
(3)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2;
(4)①分散质粒度介于1-100nm的分散系属于胶体,胶体具有丁达尔效应、聚沉的性质,不能通过半透膜;
②根据反应中元素的化合价的变化来判断氧化剂以及被氧化的元素;
③依据反应中硫酸所含元素化合价变化情况判断解答;
④根据电子转移的数目与氧化剂或还原剂之间的物质的量的关系进行计算.
解答 解:(1)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol-1
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1;
(2)H2S热分解制氢为吸热反应,常向反应器中通入一定比例空气,使部分H2S燃烧可为H2S热分解反应提供热量,
故答案为:部分H2S燃烧可为H2S热分解反应提供热量;
(3)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2,故答案为:2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2;
(4)①反应中C被氧化生成CO2、K2Cr2O7被还原为Cr2(SO4)3依据反应过程中得失电子守恒和原子个数守恒可配平方程式得:
3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,
故答案为:3;2K2Cr2O7;8;3CO2;2K2SO4;2;8;
②分析所给物质的化合价氧化剂为K2Cr2O7,还原产物为Cr2(SO4)3,还原剂为C,氧化产物为CO2.故答案为:K2Cr2O7;C;
③H2SO4在上述反应中所含元素化合价不变,与金属阳离子结合生成盐,表现出酸性,故答案为:C;
④依据方程式可知每生成3mol二氧化碳气体,反应转移电子的物质的量为12mol,所以若反应中电子转移了0.8mol,则生成二氧化碳气体的物质的量为0.2mol,标况下体积为:0.2mol×22.4L/mol=4.48L;
故答案为:4.48L.
点评 本题考查根据盖斯定律计算反应热,氧化还原反应方程式的配平,氧化剂、还原剂等概念的了解和判断,以及有关氧化还原反应的简单计算,做题时注意正确判断化合价的变化,从氧化还原反应氧化剂和还原剂得失电子数目相等进行配平和计算.


科目:高中化学 来源: 题型:实验题
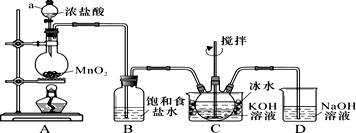
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Na+>Al3+>S2->Cl- | B. | 沸点:F2<Cl2<Br2<I2 | ||
| C. | 碱性:LiOH<NaOH<KOH<RbOH | D. | 熔点:Li>Na>K>Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
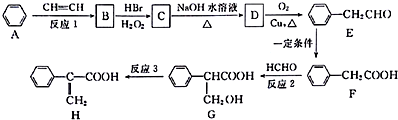
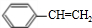 .
.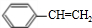 +HBr→
+HBr→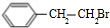 ;②D-E的化学方程式是2
;②D-E的化学方程式是2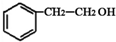 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2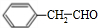 +2H2O;
+2H2O;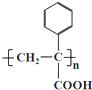
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液 | B. | c(H+)>c(OH-) 的溶液 | ||
| C. | c(H+)=1×10-7mol•L-1 | D. | c(H+)=c(OH-) 的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯(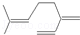 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲苯能使溴水和KMnO4溶液褪色 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com