
关于胶体的性质与应用,相关说法错误的是( )
A.静电除尘器除去空气中的飘尘是利用胶体粒子的带电性而加以除去
B.溶液和胶体均为呈电中性的分散系
C.FeCl3溶 液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象
液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象
D.由于胶粒之间的排斥作用,胶粒不易聚集成大的颗粒,所以胶体比较稳定
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
NaCl、NaClO、NaClO3的混合物中,已知Na的质量分数为23%,则氧元素的质量分数为
A.21.5% B.45.1% C.31.0% D.41.5%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
化学是以实验为基础的学科,化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列操作不是围绕上述问题的是
A. 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停止加热
B. 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气
C. 实验室制备CO气体必须在通风橱中进行
D. 蒸馏操作时应在混合液中加入沸石
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
将溶质的质量分数为10%的KOH溶液加热蒸发掉100g水后,得到溶质的质量分数为35%的溶液50mL,此时溶液的物质的量浓度为( )
A.5mol·L-1 B.3.25mol·L-1 C.7mol·L-1 D.6.25mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
A.在同温同压下,相同体积的任何气体单质所含的分子数目一定相同
B.1L 0.5mol/L FeCl3溶液完全转化可得0.5NA个Fe(OH)3胶粒
C.标准状况下,22.4L苯含有的分子数为1NA
D.在常温常压下,11.2 L氮气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:实验题
信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

(1) 第①步Cu与酸反应的离子方程式为 。
(2) 第②步加H2O2的作用是 。
(3) 该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定(原理为I2+2S2O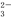 ===2I-+S4O
===2I-+S4O ),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 滴定过程中可选用________作指示剂,滴定终点的现象是____________。
② CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标
准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+。
③ 写出计算CuSO4·5H2O质量分数的表达式w=___________。
(4)请补充完整从滤渣2制备Al2(SO4)3·18H2O的实验方案:边搅拌边向滤渣2中加入_________至滤渣不再溶解,过滤, 在滤液中 、过滤、用水洗涤固体2-3次,在50℃下干燥,得到Al2(SO4)3·18H2O。(可选试剂有:硫酸溶液、氢氧化钠溶液、氨水、二氧化碳)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
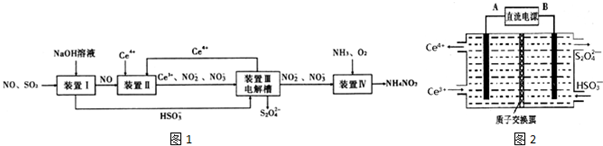
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com